Science Advances:父亲昼夜紊乱,将传递给后代,并影响后代健康
时间:2021-05-31 16:01:52 热度:37.1℃ 作者:网络
我们的生活是以24小时为周期的,包括明与暗两阶段。生物体具有昼夜节律,它将睡眠-觉醒和禁食-进食周期与明暗周期结合起来,允许身体预测日常环境变化并协调生理活动。

在哺乳动物中,昼夜节律是通过生物钟实现的。
我们生活在一个“24小时社会”,光照和食物全天候供应,日程越来越紧,压力越来越大,这会干扰我们的正常节律,并导致一定程度的昼夜节律紊乱。流行病学研究和模型生物对照研究表明,昼夜节律紊乱与代谢、精神和肿瘤等复杂疾病的风险增加有关。
尽管越来越多的证据表明,母亲的昼夜节律紊乱,无论是在怀孕之前还是怀孕期间,都会改变后代的表型,导致后代亚健康。但关于父亲的昼夜节律对后代健康的作用知之甚少。
2021年5月26日,德国环境卫生研究中心的研究团队在 Science 子刊 Science Advances 期刊发表了题为:Disruption of paternal circadian rhythm affects metabolic health in male offspring via nongerm cell factors 的研究论文。
研究团队发现父代小鼠昼夜节律紊乱的影响会传递给后代,而这种影响并非通过生殖细胞传递,而是受孕时通过精液中的皮质酮影响胎盘和胎儿组织的转录改变,进而影响后代的健康。这些发现表明,受孕时父亲的昼夜节律健康是一种新的后代表型的决定因素。
首先研究团队对雄性小鼠施行了三十天的夜间禁食,该组小鼠在白天出现高胰岛素血症,皮质酮夜间阶段开始时失去经典峰值,肝脏基因表达发生深刻的转录重编程,表明三十天的限制饮食足以扰乱雄性小鼠的昼夜节律。
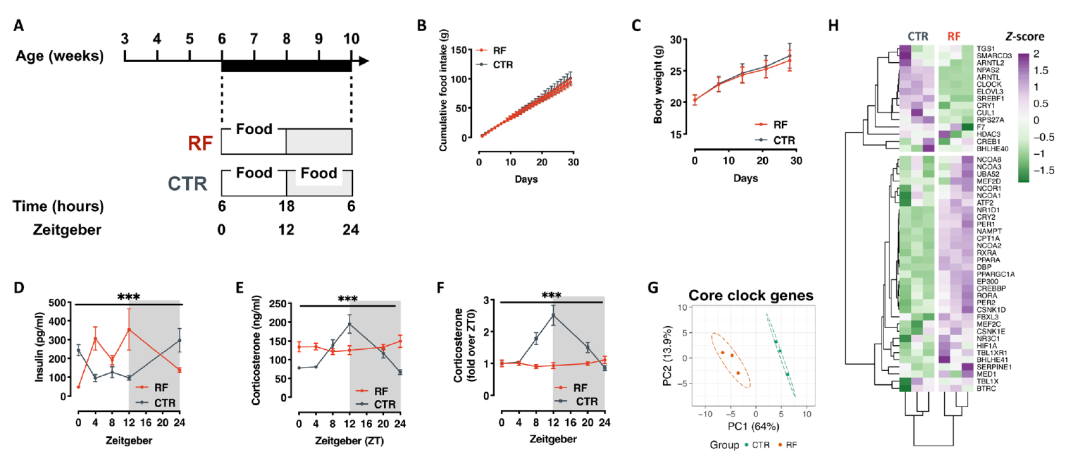
将该组雄性小鼠与未受饮食限制的母鼠交配产生的雄性后代整体食欲亢进,表现出更高的代谢率,高血糖,同时保持葡萄糖耐受。血液检测发现后代出现了高皮质酮血症。这些发现表明,父代昼夜节律的破坏会重编程雄性后代的摄食行为和代谢健康。
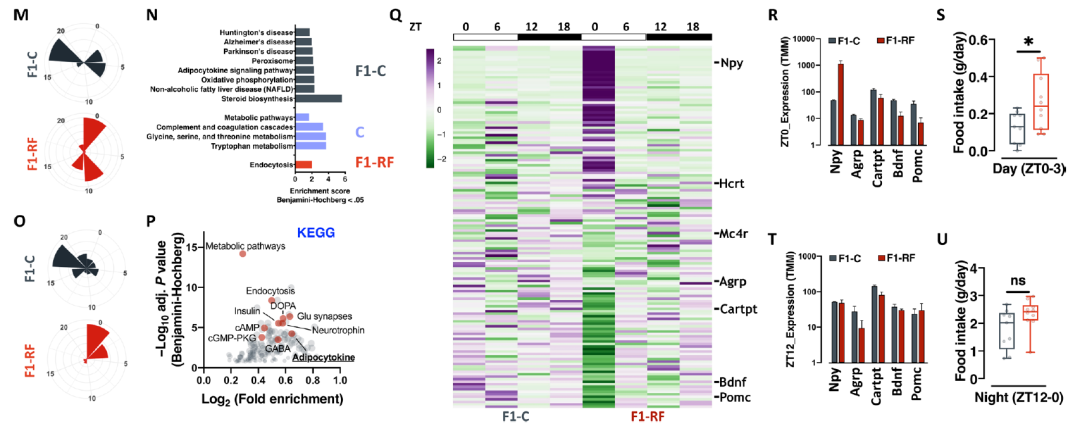
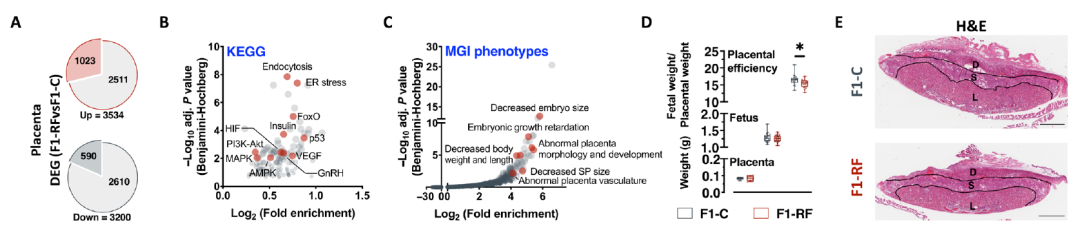
根据健康与疾病的发育起源假设,大多数个体代谢表型是在子宫内确定的。为了了解父代昼夜节律紊乱对后代健康的影响是否可以影响子宫,研究团队建立了一个独立的 F0 雄性队列,将它们与之前描述的年龄匹配且未暴露的雌性交配。
在胚胎日18.5天时,胎盘RNA-seq 显示出胎儿生长受限的基因表达模式和糖皮质激素/糖皮质激素受体(GC/GR)信号的改变。因此,父亲昼夜节律的破坏可能会导致通过胎儿生长受限观察到的后代表型和母代子宫中GC/GR信号的改变。
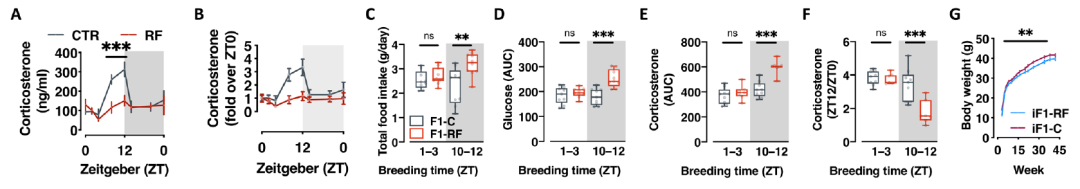
精浆含有成熟精子的营养因子和一系列对受精、着床、胎盘和妊娠结局很重要的细胞因子、激素和代谢物。研究团队测量了不同光照时间下饮食限制与对照雄性精浆中的皮质酮浓度,发现三十天的夜间禁食严重抑制了精液中皮质酮的节律性,在昼夜转换时的峰值明显不那么明显。
为了检验精液中皮质酮减少对于父系昼夜节律紊乱的代际后果很重要的假设,研究团队建立了一个当精浆中的皮质酮水平在对照组与饮食限制组雄性之间没有显着差异的新队列。该队列的后代小鼠食欲亢进、代谢失衡趋于正常化。表明受孕时的皮质酮信号对于父代昼夜节律紊乱对后代表型的影响很重要。
综上所述,该研究使用了经过验证的父代夜间禁食干扰昼夜节律的环境模型,并表明父代的昼夜节律对后代的进食行为、葡萄糖控制和激素水平很重要。父代只要三十天的限制饮食就足以在正常明暗循环和随意喂养的雄性后代中诱发食欲亢进、高血糖和皮质酮节律紊乱。胎盘的分析揭示了父代昼夜节律紊乱的后代中胎儿生长受限的转录特征。因此,父代的昼夜节律可能通过改变子宫内的发育环境来控制后代的新陈代谢,进而影响后代健康。
原始出处:
Maximilian Lassi, et al. Disruption of paternal circadian rhythm affects metabolic health in male offspring via nongerm cell factors. Science Advances 26 May 2021: Vol. 7, no. 22, eabg6424. DOI: 10.1126/sciadv.abg6424.


