Diabetes:COVID-19的老年肥胖糖尿病患者可能通过GRP78 (BIP/HSPA5)参与到脂肪组织中
时间:2021-10-31 16:03:29 热度:37.1℃ 作者:网络

背景:新型β-冠状病毒SARS-CoV-2 (COVID-19)疫情在全球迅速蔓延,迄今已造成1.69亿多人感染,350多万人死亡。严重急性呼吸综合征的发展是COVID-19患者严重进展和死亡的主要因素。新的研究表明,随着年龄、肥胖、内脏肥胖和糖尿病患病率的增加,不良结局的风险也会增加,但相关的分子机制尚未得到解释。脂肪组织在能量稳态的调节中起着重要的作用,但脂肪组织的异常会对系统的健康状态产生有害的影响。与衰老或肥胖相关的脂肪组织,特别是内脏区域的病理扩张,促进各种代谢性疾病及其并发症的发展。高胰岛素血症是一种慢性高胰岛素水平状态,常见于老年或肥胖患者,并在脂肪组织中引起有害的细胞应激,如活性氧、内质网应激、缺氧和炎症产生。最近,脂肪组织被认为是SARS-CoV-2感染(COVID-19)中病毒脱落/传播、免疫激活和细胞因子扩增的主要宿主。然而,人们对其分子机制知之甚少。
方法:
材料信息:在免疫印迹分析中,使用了以下抗体:抗FLAG(Sigma#F3165,M2)、抗His(Cst#12698,Santa Cruz#sc-8036)、抗C9(Santa Cruz#sc-57432)、抗GRP78(Cst#3177)、抗XBP-1s(Cst#12782)、抗ACE2(Abcam#ab108252)和抗SARS-CoV-2 SPEK(Abcam#ab108252)。对于细胞治疗,使用以下重组蛋白:GRP78(Abcam#ab78432)和SARS-CoV-2刺突蛋白(R&D#10549-CV)。对于HEK293过表达分析,使用以下质粒:pCMV14-3X-FlagSARS-CoV-2(Addgene#145780)、pcDNA3.1-Empty、pcDNA3.1-GRP78(Addgene#145780)和pcDNA3.1-hACE2(Addgene#145033)。对于质粒转染,根据制造商的说明使用脂质体3000。对于胞外交联,使用DTSSP(3,3’-二硫代双(磺基琥珀酰亚胺丙酸酯);Thermo Science#21578)。采用Dynabeads™蛋白G(Invitgen#10003D)和TNE缓冲液(10mMTris-HCl,150mMNaCl,1mMEDTA,1%NP-40)和蛋白酶抑制剂(NaCal#25955)和磷酸酶抑制剂(正钒酸盐2 mM,NaF 1 mM)进行免疫共沉淀分析。
转录组和CHIP-SEQ数据库分析:通过基因型组织表达(GTEx)和小鼠ENCODE计划获得人和小鼠不同组织的基因表达数据。脂肪组织的基因表达数据来自基因表达总表(Gene Expression Omnibus,GEO)。内脏和皮下脂肪组织相关数据集:基因型组织表达(GTEx)和GSE92488。与年龄相关的数据集:基因型组织表达(GTEx)和GDS6247。对象相关数据集:GDS3602和GSE71586。糖尿病相关数据集:GDS3665。胰岛素中和相关数据集:GSE35581,3T3-L1脂肪细胞。胰岛素和肿瘤坏死因子α治疗相关数据集:GSE87853,3T3-L1脂肪细胞。XBP-1S过度表达相关数据集:GDS5065。GRP78/XBP-1相关转录组:基因型组织表达(GTEx)。二甲双胍相关数据集:GSE107894。TZD相关数据集:GSE13070。CL316,243相关数据集:GSE98132。运动相关数据集:GSE68161。与卡路里限制相关的数据集:GSE60596。禁食相关数据集:GSE154612和GDS4918。冷暴露相关数据集:GDS3804,SGLT2i相关转录组来自以前的研究(26)。利用CHIP-ATLAS:GSM2292560和GSM3449388对XBP-1的芯片序列数据进行了分析。
细胞和小鼠实验:将ACE2高表达的HEK293T或Calu3细胞与SARS-CoV-2刺突蛋白共同培养24h,然后洗涤(冰冷PBS 3次)、细胞裂解和免疫印迹。在结合实验中,用SARS-CoV-2刺突蛋白(0.5~1µg/ml)在4℃处理HEK293T细胞,然后按生产说明进行DTSSP交联,ACE2+GRP78+或不+GRP78+ACE2过表达的HEK293T细胞分别加入0.5~1µg/ml的SARS-CoV-2刺突蛋白处理1h。3T3-L1脂肪细胞实验如下。简言之,3T3-L1脂肪细胞用标准分化培养基(1µM胰岛素、1µM地塞米松和0.5µM IBMX)在含10%胎牛血清和1%PS的DMEM中分化2d,然后用维持培养基(DMEM+10%FBS和1%PS)替代。用含或不含XBP-1剪接抑制剂(STF-083010,100µM)的1 nM和/或100 nM胰岛素处理7~9天的完全分化脂肪细胞48h,液氮冷冻后进行Western blotting分析。24小时禁食/喂养周期干预和SGLT2抑制剂处理(26例)的小鼠脂肪组织在液氮中快速冷冻,进行Western blotting分析。蛋白质样品在含有二硫苏糖醇(DTT)的SDS样品缓冲液中制备,加热至95°C 5min,然后加载到SDS-PAGE凝胶上。电泳后,将凝胶转移到PVDF上,用特异性抗体印迹细胞膜。使用美国国立卫生研究院(National Institutes Of Health)进行密度测量。
结果:在本研究中,我们发现SARS-CoV-2刺突蛋白与细胞表面GRP78发生物理作用,促进与ACE2表达细胞的结合和积累。GRP78在脂肪组织中高表达,并在老年和肥胖糖尿病人和小鼠受试者中增加。GRP78的过表达与脂肪细胞的高胰岛素血症有关,这部分是由应激反应转录因子XBP-1s介导的。通过药物治疗高胰岛素血症,包括二甲双胍,SGLT2抑制剂或β3-肾上腺素能受体激动剂,降低了GRP78基因在脂肪组织中的表达。环境干预,包括运动、热量限制、禁食或暴露于寒冷条件下,降低了脂肪组织中GRP78的基因表达。
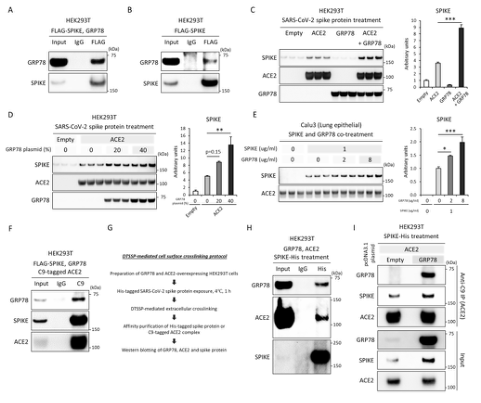
图1 GRP78与SARS-CoV-2刺突蛋白物理结合,促进与ACE2表达细胞的结合和积聚。A图中显示SARS-CoV-2刺突蛋白与GRP78共沉淀过表达的HEK93T细胞后,GRP78(Anti-GRP78)和SARS-CoV-2刺突蛋白(Anti-Flag)的Western blot图谱。B:Flag标记的SARS-CoV-2刺突蛋白过表达的HEK93T细胞免疫共沉淀后,GRP78(Anti-GRP78)和SARS-CoV-2刺突蛋白(Anti-Flag)的Western blot图像。C和D:His标记的SARS-CoV-2刺突蛋白(Anti-His)、抗C9的ACE2(Anti-C9)和抗GRP78(Anti-GRP78)经His标记的SARS-CoV-2刺突蛋白处理24小时后,HEK293T细胞中空的、C9标记的ACE2和/或GRP78质粒过表达的HEK293T细胞的Western blot图像和密度测定。E:His标记的SARSCoV-2刺突蛋白作用于Calu3细胞24小时后,Western blot图像和密度测定SARSCoV-2刺突蛋白(Anti-His)和ACE2(Anti-ACE2)。F:Flag标记的SARS-CoV-2刺突蛋白与GRP78共沉淀过表达的HEK93T细胞后,GRP78(AntiGRP78)、SARS-CoV-2刺突蛋白(Anti-Spike)和ACE2(Anti-C9)的Western blot图像。G:DTSSP介导的胞外交联协议的简要描述。H和I:GRP78(Anti-GRP78)、SARS-CoV-2刺突蛋白(Anti-His)和ACE2(H:Anti-ACE2,I:Anti-C9)的免疫共沉淀后,HEK293T细胞与空的、C9标记的ACE2和/或GRP78质粒共沉淀,经His标记的SARS-CoV-2刺突蛋白在4°C处理1小时后,免疫印迹显示GRP78(Anti-GRP78)、SARS-CoV-2刺突蛋白(Anti-His)和ACE2(H:Anti-ACE2,I:Anti-C9)。*p<0.001,**p<0.01,*p<0.05。
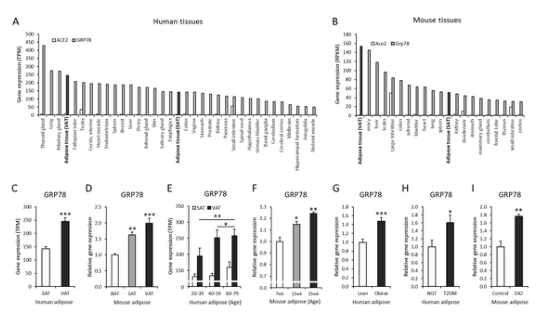
图2.GRP78在脂肪组织中高度表达,并且随着年龄的增长、肥胖和糖尿病的增加而升高。A和B:ACE2和GRP78基因在人和小鼠组织中的表达(人GTEx和小鼠ENCODE转录本:深灰色表示GRP78基因在脂肪组织中表达)。C:GRP78基因在受试者内脏(VAT)和皮下(SAT)脂肪组织中的表达(GTEx,SAT n=442和VAT n=355)。D:GRP78基因在小鼠内脏脂肪组织(VAT)、皮下脂肪组织(SAT)和棕色脂肪组织(BAT)中的表达(GSE92488,n=3)。GTEx,20~39岁,53岁(VAT)和70岁(SAT),40~59岁,181岁(VAT)和223岁(SAT),60~79岁,121岁(VAT)和149岁(SAT)。(2)GTEx基因在人体内脏和皮下脂肪组织中的表达:20~39岁,n=53(VAT)和n=70(SAT),40~59岁:n=181(VAT)和n=223(SAT),60~79岁:n=121(VAT)和n=149(SAT)。F:各年龄组(GDS6247,n=3)小鼠内脏脂肪组织中GRP78基因的表达。G:肥胖组与瘦对照组(GDS3602,n=10)皮下脂肪细胞GRP78基因表达。H:GRP78基因在糖尿病患者内脏脂肪组织中的表达,与年龄和体重指数匹配的对照组(GDS3665,n=5)进行比较。I:饮食诱导肥胖(DIO;12周高脂饮食)小鼠模型内脏脂肪组织中GRP78基因的表达(GSE71586,n=3)。数据为均值±扫描电镜。*p<0.001,**p<0.01,*p<0.05。
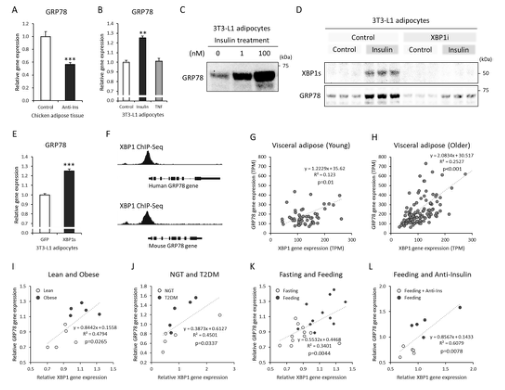
图3 GRP78是由XBP-1s介导的高胰岛素血症而上调的。A:饲喂过程中用猪抗胰岛素血清(GSE35581,n=5)中和胰岛素5h后,鸡脂肪组织中GRP78基因的表达。B:慢性胰岛素或肿瘤坏死因子α(TNF-α)处理3T3-L1脂肪细胞后GRP78基因的表达(GSE87853,对照组和TNF:n=3,胰岛素:n=2)。C:胰岛素处理3T3-L1脂肪细胞48h后GRP78蛋白的Western blot图像。D:用或不用XBP-1剪接抑制剂(XBP-1I,100µM)处理胰岛素48小时(10 NM)后GRP78蛋白的Western blot图像。E:XBP-1S过表达3T3-L1脂肪细胞后GRP78基因表达(GDS5065,n=4)。人和小鼠GRP78基因(人LNCaP细胞:GSM3449388,小鼠肝脏:GSM2292560)的XBP-1芯片序列峰(XBP1基因的启动子区域跨越外显子1)。G和H:GTEx人内脏脂肪组织中GRP78和XBP-1基因表达的相关性;青年(G:20~39岁,VAT n=53)和老年(H:60~79岁,VAT n=121);GRP78表达范围为0~800TPM,XBP1为0~300TPM。I:瘦身和肥胖女性皮下脂肪组织中GRP78和XBP-1基因表达的相关性(GDS3602,n=5)。J:对照组(年龄和体重指数匹配)和糖尿病妇女(GDS3665,n=5)内脏脂肪组织中GRP78和XBP-1基因表达的相关性。K:进食(晚上,标准餐后2h)和禁食(晚上,标准餐后26h)受试者皮下脂肪组织中GRP78和XBP-1基因表达的相关性(GSE154612,n=11)。L:饲喂过程中用猪抗胰岛素血清中和胰岛素5h后,鸡脂肪组织中GRP78和XBP-1基因表达的相关性(GSE35581,n=5)。数据为均值±扫描电镜。**p<0.01,*p<0.001。
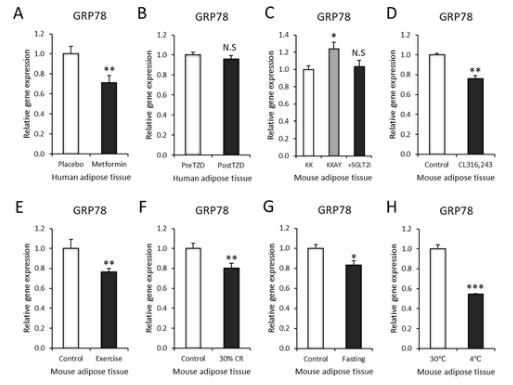
图4.GRP78在脂肪组织中的表达可以通过药物和环境干预来控制。A:二甲双胍治疗6周后,每日2次,每次500 mg,皮下脂肪组织中GRP78基因表达逐渐增加,2周后增加到每天2000 mg(GSE107894,n=14)。B:TZD治疗3个月后皮下脂肪组织GRP78基因表达(GSE13070,n=40)。C:SGLT2抑制剂(SGLT2I:达帕利嗪)治疗5周后小鼠内脏脂肪组织GRP78基因表达(n=4)。D:CL316、243处理3d后小鼠内脏脂肪组织GRP78基因表达(GSE98132,n=3)。E:车轮运动11d后小鼠皮下脂肪组织GRP78基因表达(GSE68161,n=7)。F:30%热量限制10周后小鼠内脏脂肪组织GRP78基因表达(GSE60596,n=3)。G:禁食24h后小鼠内脏脂肪组织GRP78基因表达(GDS4916,n=5)。H:GRP78基因在30°C热暴露和4°C冷暴露1周后小鼠皮下脂肪组织中的表达(GSE13432,n=3)。数据为均值±扫描电镜。*p<0.001,**p<0.01,*p<0.05。

图5.GRP78在COVID-19中的潜在角色。在老年和肥胖糖尿病患者1中,高胰岛素血症2导致细胞应激,并诱导XBP-1介导的GRP783在脂肪组织中过表达,从而促进GRP78定位于循环4和细胞表面5,而不仅仅是内质网(ER)6。GRP78在物理上与SARS-CoV-2刺突蛋白相互作用,这可能在病毒生命周期中发挥一些关键作用。S蛋白与可溶性GRP78和细胞表面GRP78的相互作用可能促进SARS-CoV-2与表达ACE2的宿主细胞的结合和感染。SARS-CoV-2上的可溶性GRP78在循环中可能诱导病毒的全身性传播和感染。SARS-CoV2与细胞表面GRP78或相关刺激物结合可激活NF-κB或JNKSTAT3转录途径,诱导细胞炎症反应。SARS-CoV-2可能利用位于内质网的GRP78作为分子伴侣来产生和组装病毒颗粒,这使得病毒能够成功复制(棕色的病毒表示新复制的SARS-CoV-2)。老年和肥胖糖尿病患者中GRP78的高表达可能与新冠肺炎的严重进展和预后有关。
结论:本研究为GRP78作为SARS-CoV-2刺突蛋白与ACE2结合伴侣的作用提供了科学依据,可能与老年肥胖糖尿病患者COVID-19的严重进展和结局有关。高胰岛素血症的管理和相关GRP78表达可能是一个潜在的治疗或预防靶点。
原文出处:
Shin J, Toyoda S, Nishitani S,et al,Possible Involvement of Adipose Tissue in Older and Obese Diabetic Patients with Coronavirus SARS-CoV-2 Infection (COVID-19) via GRP78 (BIP/HSPA5): Significance of Hyperinsulinemia Management in COVID-19.Diabetes 2021 Oct 06


