EBioMedicine:脱碘酶-3是一种调节足细胞稳态的甲状腺调节剂
时间:2021-12-06 23:01:38 热度:37.1℃ 作者:网络

背景:足细胞是肾小球内终末分化的上皮细胞,在超滤过程中起着重要作用。肾小球滤过屏障(GFB)功能障碍通常归因于足细胞损伤。足细胞代谢活跃,需要大量的能量供应,有证据表明线粒体功能障碍与足细胞病变之间存在相关性。尽管足细胞最初被认为仅仅是肾小球的结构成分,但最近发现它们具有对肾小球来源的和系统循环的激素和其他体液因子作出反应的机制。甲状腺激素是一种循环的碘化信号分子,在几乎所有细胞中调节生理和发育过程。支持这一点的是,肾脏中TH调节失调与肾小球疾病和其他肾脏并发症有关。甲亢与肾脏血流和吸收能力增加有关,而甲减则与肾小球基底膜(GBM)增厚和滤过率降低有关,这表明甲状腺的正常功能和肾脏的健康之间存在明显的重叠。此外,Graves病(一种自身免疫性甲亢形式,其特征是存在针对促甲状腺激素受体(TSH-R)的甲状腺刺激性自身抗体,导致受体激活,表现为伴有肾病综合征(NS)的膜性肾小球肾炎,也有一些零星的膜增生性肾小球肾炎或微小病变疾病的报道。另一方面,甲状腺功能减退与NS有关,但只是由于TH尿量增加而导致的次要结果。由于NS与甲状腺功能亢进症的主要结局更为密切相关,本研究的目的是明确足细胞是否以及如何对T3输入做出反应并调节T3输入,而足细胞的生物活性T细胞则被认为是甲状腺功能亢进症(甲亢)的主要结果。因此,本研究旨在确定足细胞是否以及如何对生物活性甲状腺激素(TH)3,5,3’三碘甲状腺原氨酸(T3)的输入进行反应和调节;也旨在破译3型脱碘酶(D3)在肾脏疾病中的病理生理作用。D3是一种膜结合的硒酶,可使TH失活。
方法:采用免疫荧光、qPCR和足细胞特异性D3基因敲除的方法,研究正常和损伤足细胞(PAN、嘌呤霉素氨基核苷和LPS、脂多糖介导的)D3的功能。采用表面等离子体共振(SPR)、免疫共沉淀和邻近连接分析(PLA)等方法进行相互作用研究。
免疫荧光:将小鼠或人足细胞以20 GB 103cells/ml的浓度接种到玻璃片(Marienfeld)的12孔板中,并允许如上所述进行分化。细胞用冰冷PBS冲洗,室温下用4%PFA固定10min,再用0.1%Triton X-100通透5min。盖玻片用PBS清洗2次,每次5min后,用5%驴血清(Sigma-Aldrich,D9663)封闭缓冲液室温孵育1h。免疫荧光染色:细胞与定制的兔抗人D3(1:100;Novus Biologics,NBP1-05767;RRID:AB_1556282)和/或鼠抗人突触素(1:300;D-9;Santa Cruz Biotechnology,sc-515842)在4°C孵育过夜。细胞用冷PBS洗涤,与适当Alexa Fluor488标记的驴抗兔IgG(1:1000;分子探针A-21206;RRID:AB_2535792)和/或Alexa Fluor647标记的驴抗鼠IgG(1:1000;分子探针A-31571;RRID:AB_162542)在室温下孵育1h,细胞在PBS中用0.1 mg/mlDAPI(Invitgen,D1306)染色。然后用Zen软件(Zeiss)用LSM 700激光扫描荧光共聚焦显微镜观察细胞。
逆转录定量聚合酶链式反应(QPCR)检测:根据制造商的说明,使用Trizol试剂(Invitgen)或RNAasy Mini Kit(Qiagen)从生长在三个独立孔(生物复制)中的培养细胞中提取总RNA。用分光光度法测定260 nm(A260)和280 nm(A280)的吸光度,并使用NanoDrop 2000分光光度计(Thermo Fisher Science)评估A260/A280比值,从而确定RNA的浓度和质量。小鼠甲状腺总RNA购自Takara Bio(#636674)。按照标准方法(应用生物系统,4368813)使用高容量cDNA逆转录试剂盒合成cDNA,并将其保存在-20°C下,直到进一步使用。使用CFX96实时系统热循环仪(Bio-Rad)进行PCR反应,一式三份(技术复制)。用2DDCt法将结果用归一化为gapdhmRNA水平的基因表达水平表示为折叠变化,以Dio2作为计算折叠变化的参考基因。以下TaqMan基因探针购自Thermo Fisher Science:小鼠Dio1(Mm00839358_M1)、小鼠Dio2(Mm00515664_M1)、小鼠Dio3(Mm00548953_S1)、小鼠Gapdh(Mn99999915_G1)、人Dio3(Hs00956431_S1)、人GAPDH(Hs02758991_G1)、小鼠PGC-1a(Mm01208835_M1)、鼠标Hr(Mm00498963_M1)和鼠标Tshr(Mm00442027_M1)。
足细胞特异性D3基因敲除(D3KO)小鼠模型的建立:利用成熟的Cre-loxP技术,我们选择性地灭活了成人肾小球足细胞中的D3。纯合子小鼠(Dio3fl/fl)命名为D3-Flox,由多梅尼科·塞尔瓦托(那不勒斯大学公共卫生系,意大利那不勒斯,费德里科二世)[20]实验室培育,由芝加哥大学医学系Antonio Bianco慷慨捐赠。D3的催化区含有硒半胱氨酸残基,由框内UGA终止密码子编码。然而,为了覆盖终止密码子而插入硒半胱氨酸,在mRNA的30UTR中需要一个被称为硒半胱氨酸插入序列(SECIS)的顺式作用茎环序列(SECIS)。由于SECIS元件是D3蛋白全长翻译所必需的,因此该区域在Dio3基因中被去除。为了实现这一点,我们构建了一个含有Dio3位点上漂浮位点的质粒,该质粒位于Dio3mRNA中位于ATG的1,001和1,706个核苷酸的SECIS mRNA结构的两侧。在没有SECIS的情况下,D3催化域内的TGA密码子将被识别为终止密码子,蛋白质翻译将终止[20]。我们将这些D3Flox小鼠与足细胞特异性Nphs2启动子下表达Cre重组酶的驱动鼠品系(Pod-Cre小鼠)(取自Jackson实验室)杂交,产生D3KO小鼠(Pod-Cre+/Flox::Dio3flx/Flox)。所有小鼠均以纯C57BL/6J(B6)为背景。在Pod-Cre转基因存在的情况下,D3KO小鼠将有足细胞特异性地切除花状dio3 SECI,导致空等位基因终止于UGA密码子,没有D3催化活性。Podocin-Cre仔猪作为对照。用CflipU和FflipL引物确定lox位点,用pod-cre-f和pod-cre-r引物确定cre位点,证实了预期的重组事件发生在后代中。为了进一步证实D3KO小鼠足细胞中缺乏D3的表达,从10周龄D3KO小鼠的肾小球或产仔对照鼠肾小球中分离出原代足细胞,如下2.7节所述。用兔抗D3抗体(10 mg/ml,Novus Biologics#NBP1-05767)进行Western blot分析,用ImageJ软件计算D3带的相对密度,归一化为GAPDH,并与窝产仔对照组(每组3只)进行比较。
结果:健康足细胞表达D3作为主要的脱碘酶亚型。足细胞损伤后,无论是在体外还是在LPS小鼠足细胞损伤模型中,Dio3转录和D3蛋白的水平都显著降低。D3不再定位于细胞膜,而是聚集在高尔基体和细胞核中。此外,耗尽小鼠足细胞中的D3会导致足突消失和蛋白尿。小鼠足细胞经T3处理后,D3缺失,Avb3整合素信号被激活,导致足细胞损伤。我们还证实了小鼠足细胞上存在活性促甲状腺激素受体(TSH-R),这种受体的参与和激活会导致足细胞损伤。
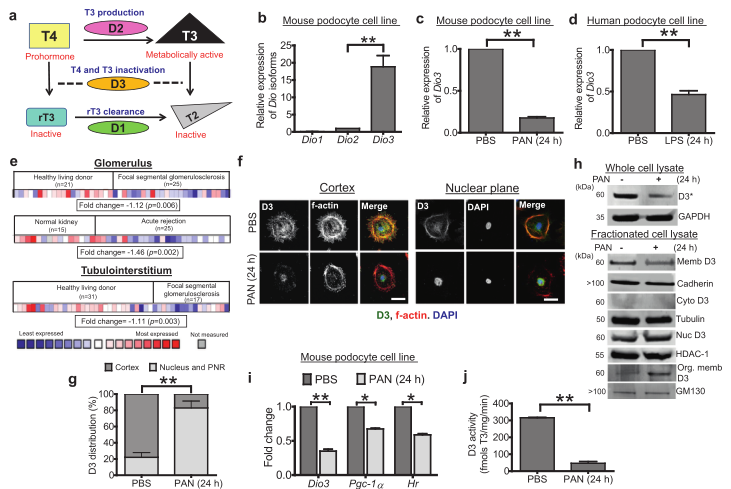
图1 脱碘酶3(dio3,D3)是小鼠足细胞中含量丰富的异构体。(A)示意图显示脱碘酶II型(D2)将最初释放的激素前体甲状腺素(T4)转化为T3。D3通过还原消除碘使TH的活性形式T3失活。(B)小鼠足细胞脱碘酶的qPCR分析,以DIO_2为参照物,用非参数Studentst检验法测定~(*)p~(0.01),并与看家基因进行比较。(2)小鼠足细胞脱碘酶的qPCR分析,以DIO_2为参照物,用非参数Studentst检验。(C)用PAN(30 mg/ml作用24h)对小鼠足细胞中的DIO3进行定量PCR分析。以GAPDH为看家基因,以DIO2为参照物,采用非参数Studentst检验确定**p<0.01。(D)人足细胞中DIO3在LPS(50 mg/ml作用24h)作用下的qPCR分析,以DIO2为参照物,以Gapdh为看家基因,采用非参数Studentst检验确定**p<0.01。(E)Nephroseq数据库,显示DIO3转录本在指定条件下在不同类型肾细胞中的表达谱。折叠变化(log2以中值为中心的强度)和p值也显示在每个阵列下方的框中。下面显示了描述表达范围从最少(蓝色)到最多(红色)和未测量(浅灰色)的关键字。(F)共聚焦显微照片,观察处理后24小时未处理(UT)或PAN处理的小鼠足细胞的皮质。底部的面板显示了相同样本。D3和肌动蛋白共同定位于足细胞的皮质。染色:左柱为a-D3灰阶,中柱为F-actin灰阶,右柱为绿色合并ofa-D3,红色为f-actin,蓝色为DAPI。比例尺=50 mm。(G)在f,**p<0.01中足细胞中观察到的D3荧光强度分布的量化。(H)通过分离小鼠足细胞获得的不同细胞室中D3的Western blot分析。用细胞膜标记钙粘附素、胞质标记微管蛋白、细胞核标记HDAC-1和高尔基体标记GM130鉴定其纯度。*D3已知在»60 kDa时以二聚体的形式迁移。(1)对PAN(30 mg/ml,24h)处理的小鼠足细胞进行HR和PGC-1的qPCR分析,以gapdh作为看家基因,用非参数Studentst检验测定**p<0.01和*p<0.05。(J)UPLC法测定D3酶活性。对未经处理和PAN处理(24小时)的小鼠足细胞的总裂解产物中TH的脱碘产物的峰值进行了量化,并绘制了T3到T2转化率的曲线图,**p<0.01。
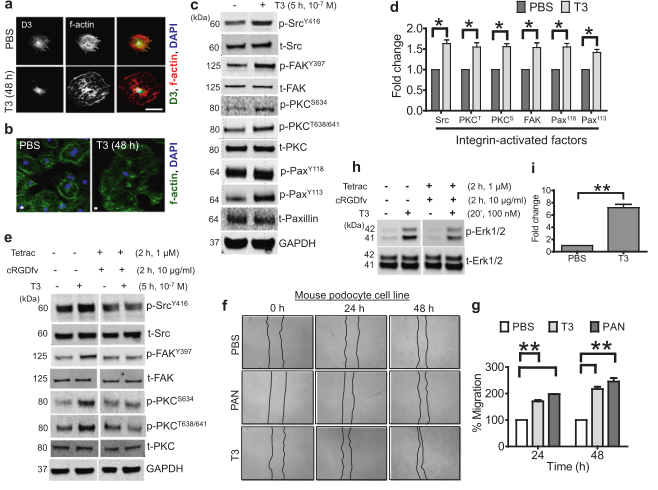
图2 过量的TH信号(甲亢)影响细胞骨架组织,诱导avb3整合素信号,增加小鼠足细胞的迁移和损伤。(A)未处理(UT)或T3处理(10~7M)48h的培养小鼠足细胞共聚焦显微镜,染色:左柱,a-D3灰阶,中柱,F-actin灰阶,右柱,a-D3合并为绿色,F-actin为红色,DAPI为蓝色。比例尺=50 mm。(B)显示未处理(UT)或处理T3(10-7M)的培养小鼠足细胞的合并共聚焦显微照片,用Phalloidin-488(绿色)和DAPI(蓝色)染色F-actin。比例尺=10 mm。(C)用10~(-7)M~(3+)处理足细胞5h后进行Western印迹分析,并用所示抗体进行探针检测。给出了三个独立实验的代表性印迹。分子量标准的迁移在左边用kDa表示。(D)使用Licor-Biosciences Odysey软件对c中所示的斑点进行条带强度的量化。通过将磷酸化因子与其对应的总因子进行归一化处理,计算表达水平的倍增变化,并以PBS处理的足细胞为基线。此外,GAPDH还被用作加载控件。统计学处理采用非参数双尾学生检验,P<0.05。(E)用10~(-7)M T3单独处理足细胞5h作为对照,或在T3处理前加入抑制剂鸡尾酒(cRGD,10 mg/ml和Tetrac,1 mM)作用2h,进行Western blot分析。用指定的抗体对印迹进行探测。给出了三个独立实验的代表性印迹。分子量标准的迁移在左边用kDa表示。(F)通过使用微吸管在12孔板中的80%汇合的小鼠足细胞单层上产生一个直线划痕,在独立的三个孔板中产生了一个“伤口”。“伤口”是通过使用微量吸管在12孔板中穿过80%融合的小鼠足细胞单层而产生的。以10~(-7)M T_3或3.0 mg/ml PAN处理细胞为阳性对照,分别于0、24、48h拍摄图像,与未处理组相比,T3处理组具有代表性的明场图像显示创面愈合加快。虚线定义了缺少单元格的区域。(G)对f中所示的数据进行量化。使用Image J软件计算迁移面积或伤口闭合的百分比为:A0h(0h时的伤口面积,即紧接着进行划伤后)-Axh(在开始划伤后的给定小时测量的伤口面积)/A0h。统计学处理采用非参数双尾学生检验,P<0.01。(H)用磷酸化ERK1/2抗体和总ERK1/2抗体检测10-7M T3处理足细胞20min后的Western blot分析。(I)描述了在h中获得的带强度的量化。统计学P<0.01。
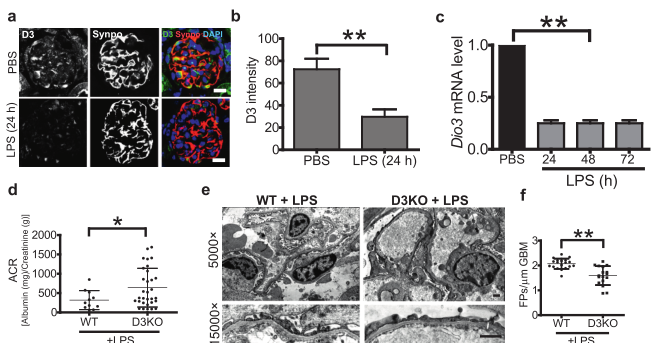
图3 脂多糖诱导的蛋白尿在足细胞特异性D3基因敲除小鼠(D3KO)中更为严重。(A)10周龄小鼠肾脏共聚焦显微镜显示,注射LPS(10 mg/kg)24h后肾小球D3表达减少,突触素染色证实。左栏,a-D3灰度;中柱,a-Synaptopodin灰度;右栏,a-Synaptopodin合并为绿色,a-Synaptopodin为红色,DAPI为蓝色。BAR=10 mm。(B)肾小球D3强度的量化,采用非参数双尾检验计算显著性,**p<0.01。(C)定量PCR分析LPS处理的小鼠肾小球中DIO3mRNA的表达,采用非参数双尾学生检验计算其显著性,**p<0.01。(D)测定10周龄D3KO小鼠(n=31)或仔鼠对照组(n=11)腹腔注射LPS(5 mg/kg)后24h尿白蛋白(Mg)/肌酐(G)比值(ACR)的曲线图,采用非参数双尾Studentst检验计算其显著性,P<0.05。(E)注射LPS后24小时小鼠肾小球毛细血管环的典型透射电镜照片,放大5000 GB和15,000 GB。FP消失如箭头所示。(F)通过计算每个样本中每mm GBM的FP数来量化FP的消退,采用非参数双尾Studentst检验来计算显著性,**p<0.01。
结论:这项研究为D3-αvβ3整合素相互作用如何使T3依赖的整合素激活最小化提供了证据,说明了D3如何在足细胞中扮演肾保护性甲状腺激素的角色。此外,在Graves病患者中发现的TSH-R与TSH-R抗体结合造成的损伤,解释了甲状腺疾病和NS之间可能存在的联系。
原文出处:
Agarwal S, Koh KH, Tardi NJ,et al.Deiodinase-3 is a thyrostat to regulate podocyte homeostasis.EBioMedicine 2021 Oct 11;72


