通过全血转录组学分析确定特发性肺动脉高压的生物学异质性
时间:2021-12-15 12:01:19 热度:37.1℃ 作者:网络
肺动脉高压 (PAH) 是一种罕见但具有破坏性的疾病,其特征是持续的肺血管收缩和进行性肺血管重构。这会导致肺血管阻力和肺动脉压力增加,从而导致右心衰竭和死亡。特发性PAH (IPAH) 的原因仍然未知,诊断是从排除其他形式的PAH中得出的,导致了一组异质性的患者,这些患者在临床队列和注册研究中的生存期和治疗反应有显着差异。
PAH 的病理生物学涉及常驻血管细胞(包括内皮细胞、动脉平滑肌细胞和成纤维细胞)与浸润性炎症细胞的复杂相互作用,并且已被证明受越来越多的分子和遗传机制。 我们已经确定了遗传性和特发性 PAH (H/IPAH) 中的罕见突变和常见变异,这进一步深入了解了 PAH 的遗传基础。额外的蛋白质组学、代谢组学和转录组学研究已经描述了诊断和预后生物标志物,这些生物标志物增加了我们对这一队列中调节疾病的分子机制的日益了解。我们将临床定义的 H/IPAH 病例与健康对照进行了比较,并为 H/IPAH 定义了不完善的诊断特征;然而,我们之前没有检查过H/IPAH病例中存在的分子异质性。血液样本的深度RNA分析提供了可用于检测罕见疾病的生物标志物,并定义了心肌梗塞背后的分子机制。因此,我们研究了全血的转录组学分析是否可以提供比目前标准临床分类所允许的更好的 H/IPAH 分子“内表型”,以更好地对患者进行分层。此外,我们假设这些转录组定义的亚组将提供对驱动疾病的生物学途径的额外见解,以及为 H/IPAH 的精准医学方法提供途径的潜在药物靶点。
在这项研究中,使用无监督机器学习对全血中的转录组模式进行评估,与 H/IPAH 的临床定义和描述无关。我们描述了将患者无偏见地划分为多个不同的转录组亚组,这些亚组与不同的生存特性相关,每个亚组都具有预测性的临床和遗传特征。具体而言,我们强调了免疫和免疫基因在区分与不同患者结果相关的 PAH 内表型中的潜在作用。这些数据进一步强调了炎症是PAH发病机制的重要介质的概念。以及从PAH患者的血液细胞因子谱中发现了不同的免疫亚群。最后,我们确定了一组特定的临床特征,这些特征描述了每个转录组亚组,并在未使用其临床表型数据进行完整转录组分析的验证队列中复制这些亚组。随后确认了关键簇相关基因的基因表达谱,并在内部和外部验证队列中验证了与关键临床变量的相关性,从而验证了我们的方法,并提供了一种替代方法来定义这些内表型,而无需转录组数据。
研究主要结果:
全血转录组的无监督聚类分析揭示了 H/IPAH 的五个不同亚组
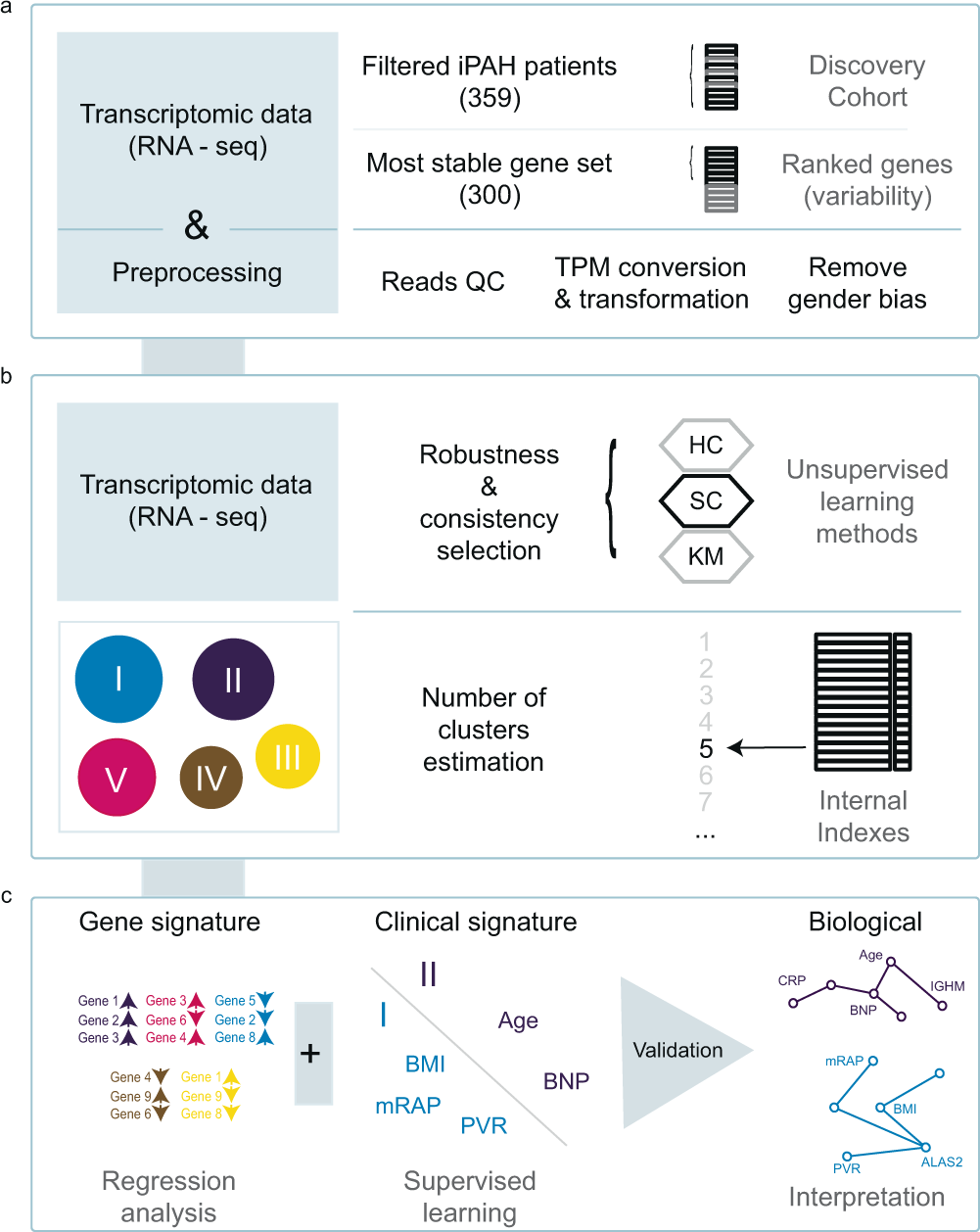
a根据 RNA 数据质量和样本间表达的可变性,选择了 359 名 IPAH 患者和一组 300 个基因进行聚类。b使用表达值 (TPM) 对患者进行光谱聚类以分层聚类 (HC) 和k均值聚类 (KM ) 为基准,并根据内部指标选择 IPAH 亚组的最佳数量。c相关基因表达和临床特征在独立队列中得到鉴定和验证。
显示五个不同亚组的基因表达谱、存活率和风险类别。
a五个发现的亚组的表达热图显示不同的表达谱。b三个主要亚组的 Kaplan-Meier 生存曲线证明了 5 年跨度的生存概况(来自 RNA 采样)以及两侧对数秩检验p值的差异。c跨 REVEAL 风险类别的主要亚组 I、II 和 V 患者的百分比。高危和极高危人群主要由亚组 I 患者组成(分别为 45.5% 和 73.3%),而低危人群主要由亚组 II(38.3%)和 V(29.5%)患者组成。Fisher 精确检验显示出统计学上的显着差异(两侧p 值 = 0.024)在低风险和极高风险类别的亚组 I 和 II 之间。
与亚组 I(低存活率)、II(高存活率)和 V(中等存活率)相关的基因。
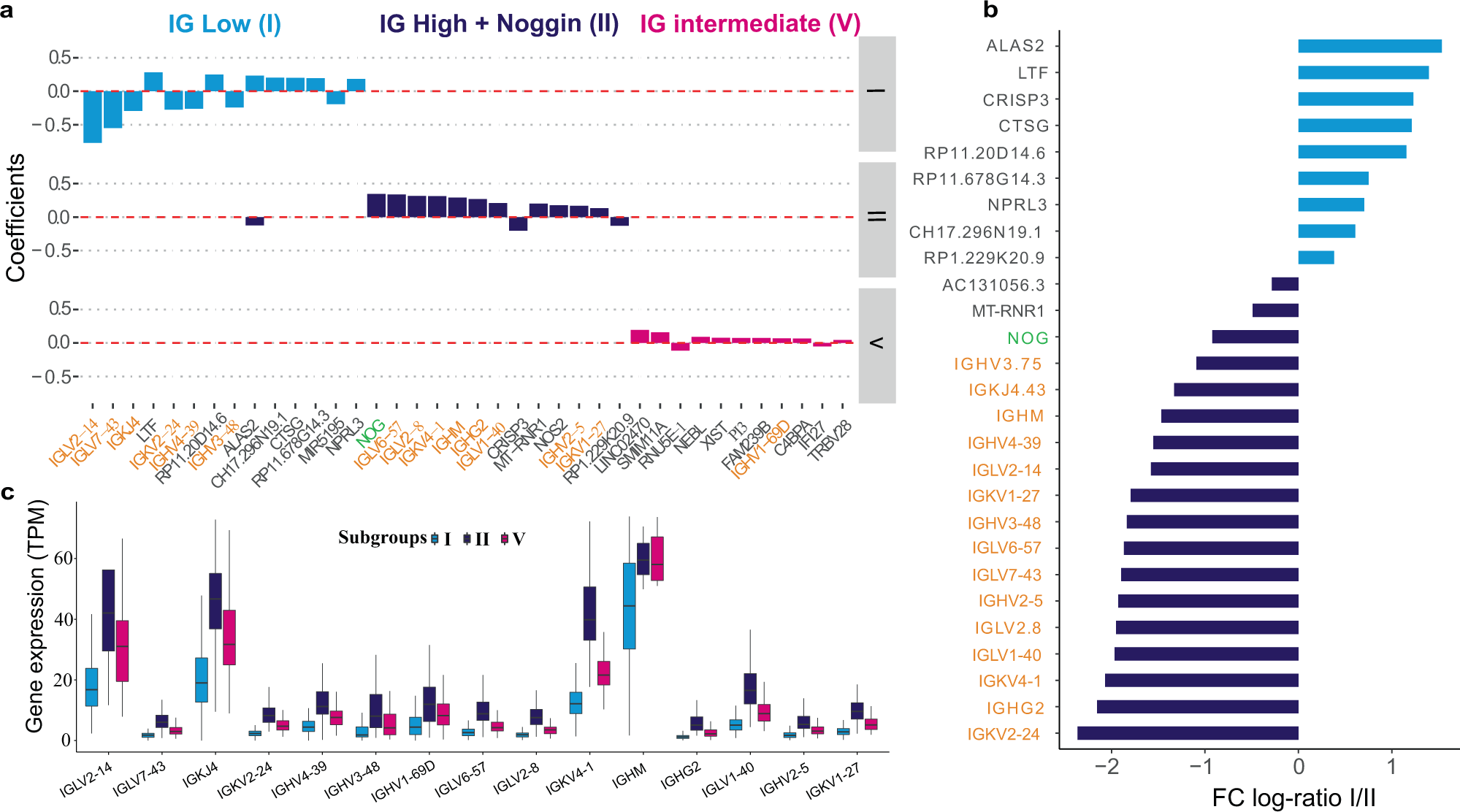
a在亚组 I、II 和 V 中具有最高 5% 的 LASSO 系数的基因。b亚组 I 和 II 之间特征基因的平均表达倍数变化(log 2缩放),带有显着性符号。在亚组 I 中过度表达的基因用浅蓝色条表示,而主要在亚组 II 中表达的基因用深蓝色条表示。c由 LASSO 选择的免疫球蛋白基因在三个主要亚组中的表达水平,显示了中位数。亚组 I ( n = 134)、V ( n = 98) 和 II ( n = 119) 可以定义为具有低、中和高免疫球蛋白特性。垂直中心线代表中值,盒子的上下边界代表第一个和第三个四分位数,而尖端代表最小值和最大值。
跨 PAH 转录组亚组的免疫细胞组成。
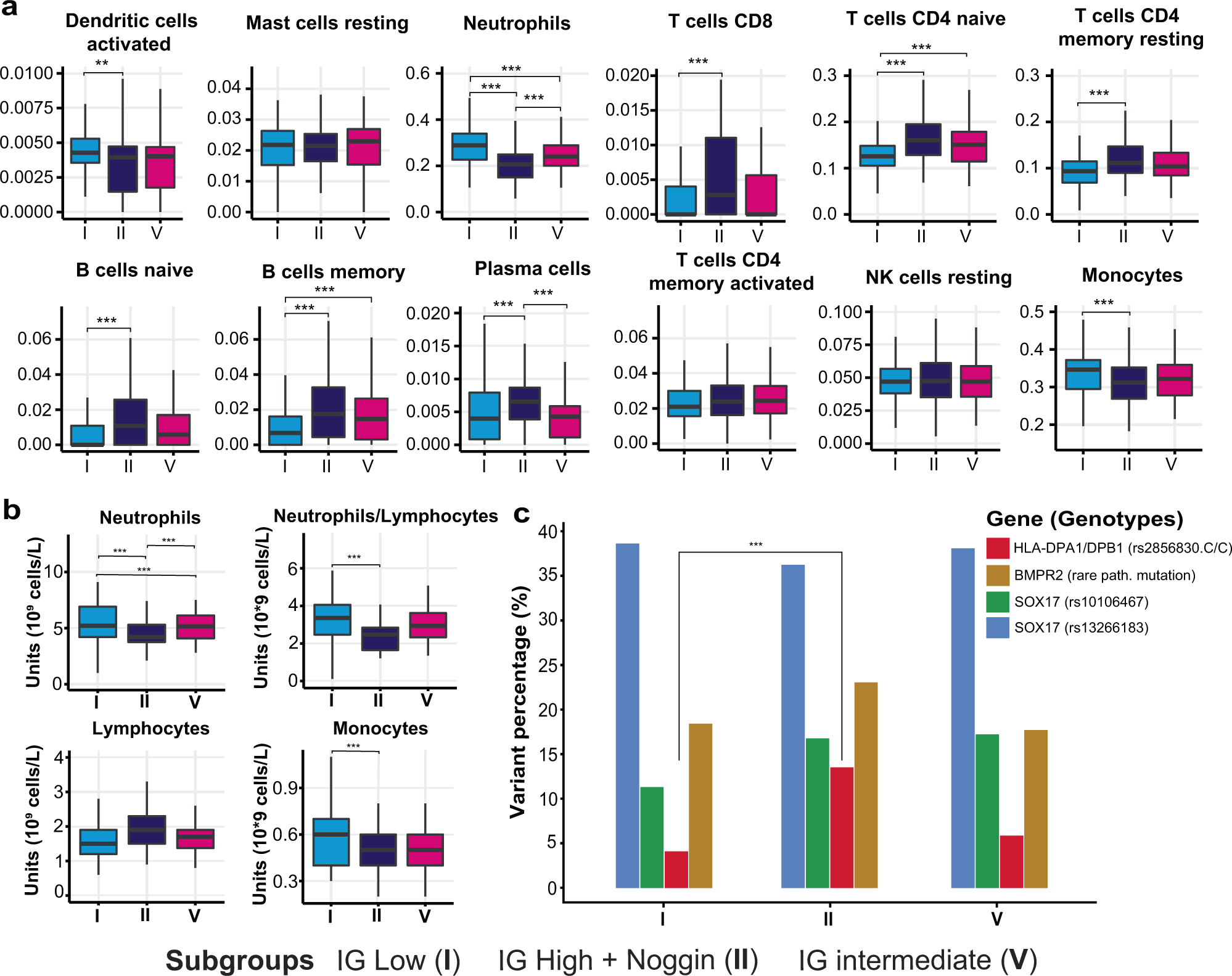
在亚组 I 和 II 的样本之间观察到淋巴细胞和中性粒细胞比例的显着差异(p < 0.01)。
RNA亚组的常见临床特征-描述 RNA 亚组并用于新患者分类的临床变量。
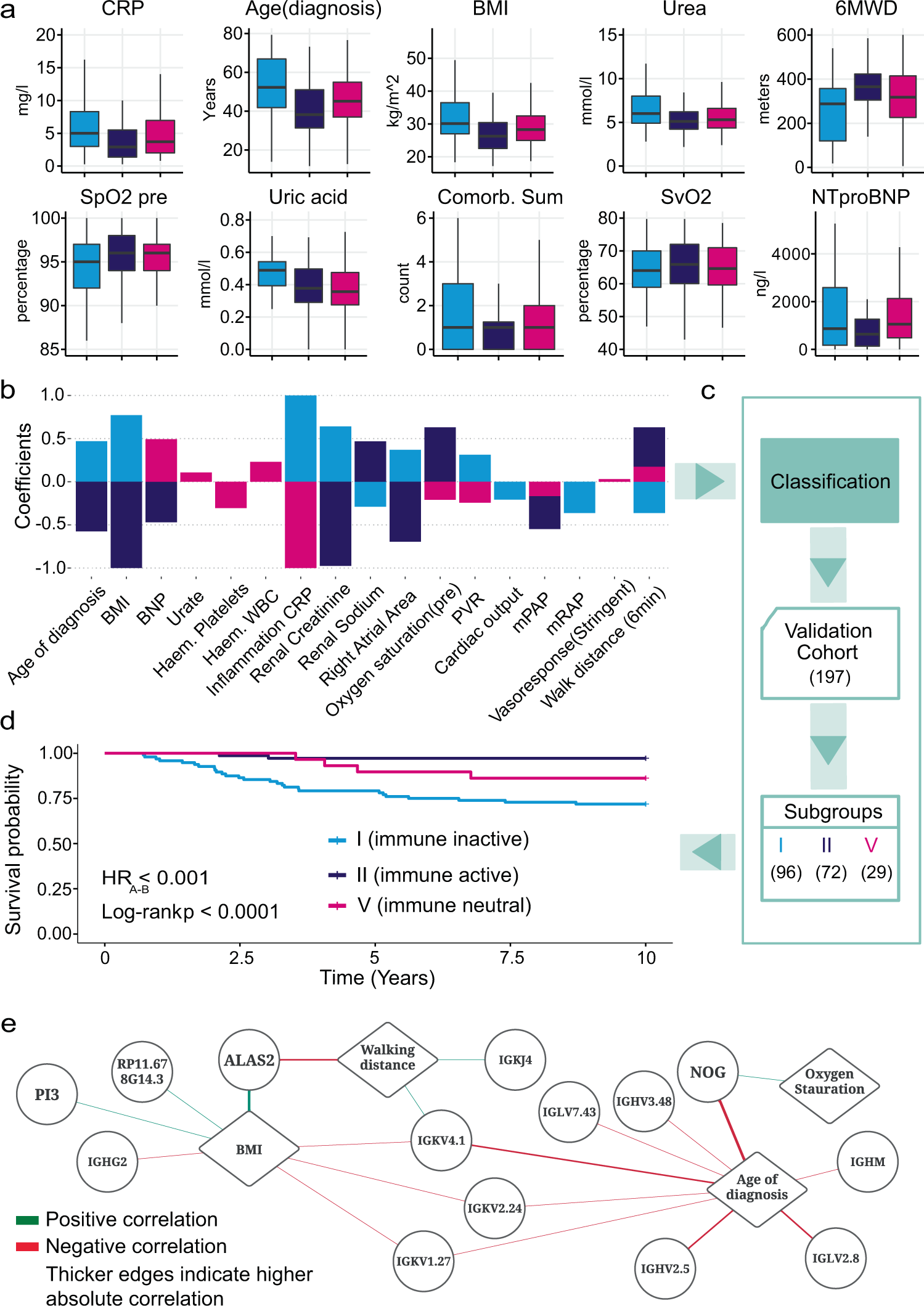
a比较我们的单变量特征选择模型中最重要的临床变量在亚组 I ( n = 129)、II ( n = 112) 和 V ( n = 89) 中。垂直中心线代表中值,盒子的上下边界代表第一个和第三个四分位数,而胡须的尖端代表最小值和最大值。b通过整体特征选择从预测每个亚组的模型中选择的临床变量。为每个变量显示的系数来自最具预测性的支持向量机分类器。c选定的临床特征用于对来自独立验证队列的 197 名 IPAH 患者进行分类。d验证队列中每个预测亚组的 Kaplan-Meier 生存曲线证实了亚组之间生存结果的差异以及对数秩检验p值。e基因和临床变量相关网络。菱形节点代表从临床特征中提取的临床变量。圆形节点代表从我们的 LASSO 模型生成的基因特征中提取的基因。
研究讨论:
在这项研究中,我们描述了一种机器学习方法来识别遗传性或特发性 PAH 患者的转录组相关亚组或内表型。我们根据临床表现、严重程度和存活率定义了五个不同的临床亚组。三个最大的亚组显示出显着不同的临床特征、严重程度和生存结果,表明 PAH 的分子分类可能是可能的。我们还确定了随着时间的推移随着治疗和疾病进展通过这些亚组进展的患者,其中大多数留在他们的亚组内,只有少数过渡到中间亚组 V 或从中间亚组 V 过渡。免疫球蛋白基因、NOG和ALAS2的失调,最能预测具有最佳和最差预后的亚组,表明这些基因是决定患者结果的关键,因此可能代表未来的药物靶点,但也是识别对当前治疗有反应的患者的工具。全血中细胞计数的估计显示,在预后较好的亚组中,淋巴细胞(尤其是 T 细胞)水平升高,炎症标志物水平较低。我们进一步根据这些新 RNA 亚组的相关临床特征生成分类器,并使用它来识别独立队列中生存结果不同的亚组。
文献出处:
Kariotis S, Jammeh E, Swietlik EM, Pickworth JA, Rhodes CJ, Otero P, Wharton J, Iremonger J, Dunning MJ, Pandya D, Mascarenhas TS, Errington N, Thompson AAR, Romanoski CE, Rischard F, Garcia JGN, Yuan JX, An TS, Desai AA, Coghlan G, Lordan J, Corris PA, Howard LS, Condliffe R, Kiely DG, Church C, Pepke-Zaba J, Toshner M, Wort S, Gräf S, Morrell NW, Wilkins MR, Lawrie A, Wang D; UK National PAH Cohort Study Consortium. Biological heterogeneity in idiopathic pulmonary arterial hypertension identified through unsupervised transcriptomic profiling of whole blood. Nat Commun. 2021 Dec 7;12(1):7104. doi: 10.1038/s41467-021-27326-0. PMID: 34876579.


