Int J Nanomedicine:高表达HIF-1α的脂肪干细胞胞外囊泡通过促进成纤维细胞增殖和迁移修复糖尿病创面
时间:2021-12-22 11:01:54 热度:37.1℃ 作者:网络

糖尿病是一种常见疾病,氧化应激、炎症或糖脂毒性导致的胰腺β细胞功能障碍在糖尿病中发挥关键作用。糖尿病患者的伤口愈合通常极其缓慢,有些伤口甚至不能完全愈合,感染使治疗更加复杂。然而,目前尚无有效的治疗方法。已有报道称治疗糖尿病患者的伤口的新方法,如一氧化碳和光疗,但这些方法没有得到广泛应用,治疗也不够彻底。目前通过对糖尿病创面缺氧的研究,我们发现缺氧诱导因子-1α在促进难治性创面愈合方面可能是有效的。缺氧诱导因子-1α在缺氧环境中迅速降解,并在缺氧条件下迅速介导细胞对缺氧的适应。缺氧诱导因子-1α是细胞代谢、炎症、纤维化、血管重塑和血管生成的重要因子。
目的:抑制细胞对缺氧的适应可引起持续性炎症,从而增加糖尿病患者的组织损伤并使伤口愈合复杂化。调节细胞对缺氧环境的适应有助于有效的创面修复。缺氧诱导因子(hypoxia -inducible factor, HIF)-1α是细胞缺氧的关键调节因子。细胞外泡(EVs)调节创面修复。本研究探讨了脂肪源性干细胞细胞外囊泡(ADSCs-hEVs)中HIF-1α过表达在糖尿病创面修复中的作用机制。
材料与方法:研究HIF-1α在糖尿病患者和健康参与者中的表达情况。我们进行了人类脂肪干细胞(HADSCs)的原代培养,最后在37°C的5%CO2湿度环境中进行了培养。类似地,我们进行了人成纤维细胞(HF)的原代培养。将糖尿病患者和正常人的皮肤组织立即−80°C保存,进行定量逆转录聚合酶链式反应(QRTPCR)检测。高通量测序、GO和KEGG分析显示,ADSCs细胞外小泡缺氧环境可能通过影响细胞代谢、分化和TGF-β分泌,或通过改变PI3K/AKT通路增加HIF-1α的表达。采用Western blotting、EdU实验、transwell实验和迁移实验研究ADSCs-hEVs加入对细胞增殖和迁移的影响。在体内,分别在7、14和21天后,采用免疫组织化学、qRT-PCR、Masson染色和H&E染色评价糖尿病创面愈合的重要因素。
结果:糖尿病患者皮肤HIF-1α表达降低,白细胞介素(IL)-6表达增加,生长因子相关指标降低。与ADSCs - EV相比,ADSCs-hEVs显著增加生长因子的表达和分泌。在体内,与ADSCs - EV相比,ADSC-hEV治疗糖尿病创面的愈合速度加快,愈合质量提高。
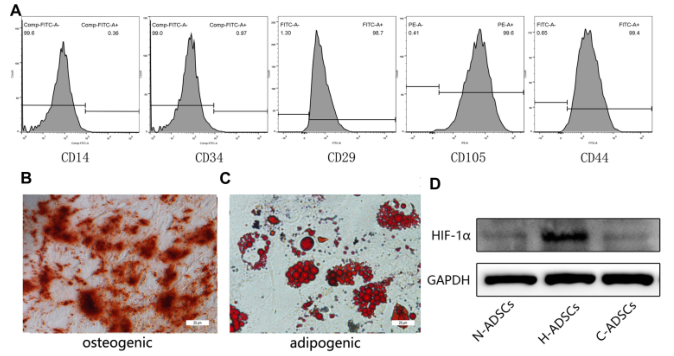
图1 HADSC的标识。(A)流式细胞仪检测hADSCs的免疫表型特征。(2)茜素红染色(100×)可见钙结节。(C)油红O染色检测脂簇。(D)免疫印迹法检测各组hADSCs中缺氧诱导因子-1α的蛋白表达水平。Bars,25μm。
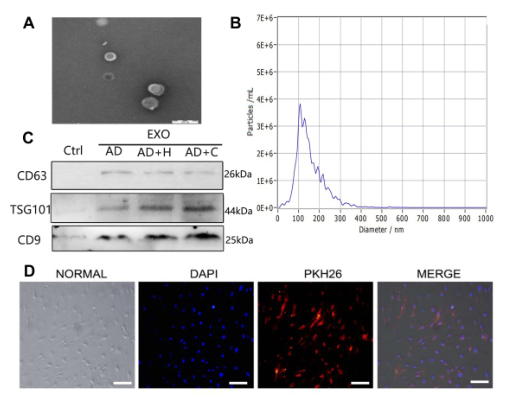
图2 ADSCs-EVS的特性。(A)透射电子显微镜下观察的形态。巴,200μm。(B)颗粒大小分布。(C)Western blot检测EVS表面标志物。(D)PKH26标记的ADSCs-EVS内化的荧光显微镜分析。Bars,100μm。
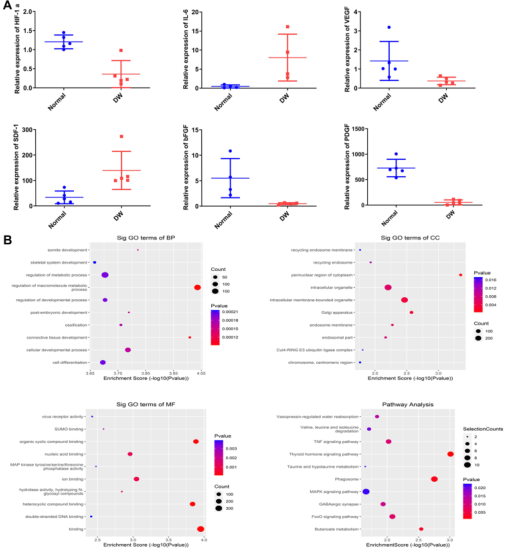
图3 正常人皮肤样本和糖尿病皮肤样本之间mRNA水平的差异。(A)定量逆转录聚合酶链反应(QRT-PCR)分析缺氧诱导因子-1(α)、碱性成纤维细胞生长因子(BFGF)、白细胞介素-6(IL-6)、血小板衍生生长因子(PDGF)、血管内皮生长因子(。(B)GO和KEGG富集差异表达的miRNAs。KEGG通路中的重要术语。N=5。数据以平均值±SD表示。
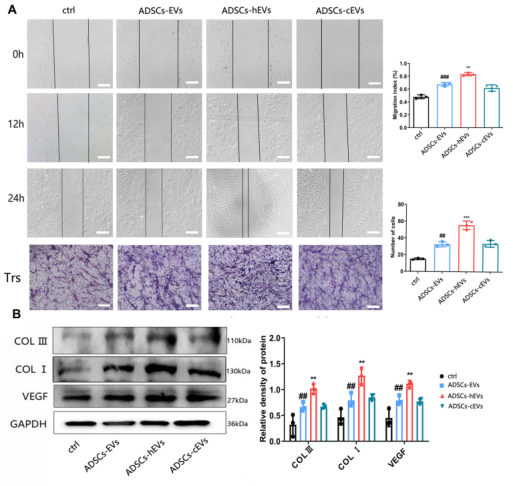
图4 ADSCs-HEV可显著促进HF的增殖和迁移。(A)ADSCs-HEV处理的HF的迁移能力,通过划痕和T-R试验测定。(B)分析经治疗的心衰患者的蛋白质表达水平。数据以平均值±SD表示。*,vs ADSCs-EVS;#,vs ctrl;n=3。**P<0.001,##P<0.001,*P<0.0001,#P<0.0001。Bars,100μm。
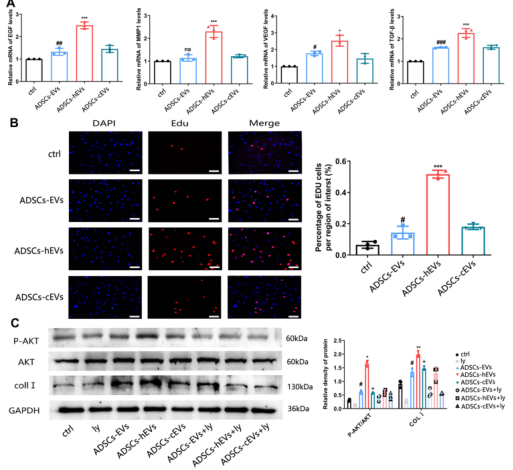
图5 ADSCs-HEV可促进HF细胞外基质和生长因子的表达和分泌。(A)定量逆转录聚合酶链反应(QRT-PCR)分析bFGF、MMP1、VEGF、TGF-β基因表达水平。(B)EDU法检测细胞增殖。*,vs ADSCs-EVs;#,vs Ctrl;(C)Western-blot分析不同浓度的对照组、ADSCs-EVs、ADSCs-HEV和ADSCs-cEVs诱导的p-AKT蛋白水平。L Y294002抑制对照组、ADSCs-EVs、ADSCs-HEV和ADSCs-cEVs诱导的PI3K/AKT激活。数据以平均值±SD表示。*VS ADSCs-HEVS+Ly;#,VS ADSCs-EVS+Ly;+,VS ADSCs-CEVS+Ly;n=3。*P<0.0001,**P<0.01,*P<0.0001,#P<0.001,#P<0.0001,+P<0.0001。

图6 ADSCs-HEV通过PI3K/AKT促进细胞增殖和迁移。(A)EDU实验显示,与ADSCs-EVS相比,抑制剂L Y294002可抑制ADSCs-HEVS处理的HF增殖。(2)定量RT-PCR检测术后14天创面组织中碱性成纤维细胞生长因子、大肠杆菌、血小板衍生生长因子、血管内皮生长因子、转化生长因子-β的表达水平。(C)ADSCs-HEV处理后0、3、7、14d。数据以平均值±SD表示。*VS DW+EVS;#,VS DW+PBS;ns,VS DW+PBS;n=3。*P<0.0 5,**P<0.0 1,*P<0.0001,#P<0.0 5,##P<0.0 1,#P<0.00001,+P<0.0001。Bars,100μm。
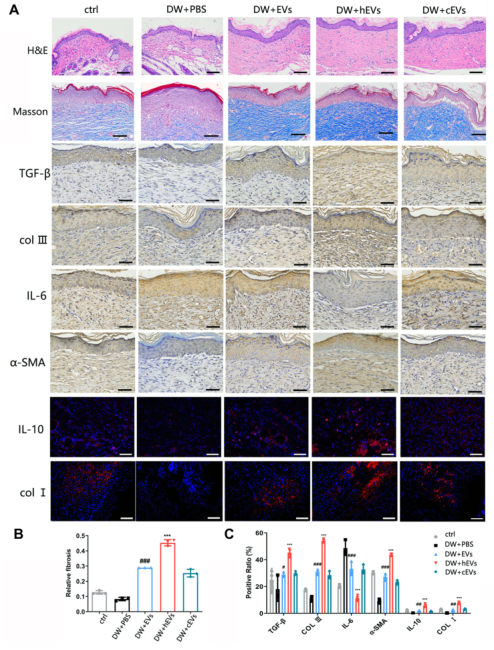
图7 术后观察创面愈合质量和愈合速度。(A)术后14d取创面进行HE和Masson染色,术后7d观察创面组织中IL-6和IL-10的表达。术后21d观察创面组织中α-SMA、β、Coli、CollⅢ的表达。N=3。(B和C)Masson、免疫荧光和免疫组织化学统计分析。数据以平均值±SD表示。*,VS DW+EVS;#,VS DW+PBS;n=6。**P<0.001,*P<0.0001,#P<0.001,#P<0.0001。Bars,100μm。
结论:ADSCs- hEVs组创面愈合速度和愈合质量明显提高,可抑制早期炎症反应,促进生长因子和细胞外基质相关指标的分泌和表达。
原文出处:
Wang J, Wu H, Zhao Y,et al.Extracellular Vesicles from HIF-1α-Overexpressing Adipose-Derived Stem Cells Restore Diabetic Wounds Through Accelerated Fibroblast Proliferation and Migration.Int J Nanomedicine 2021;16


