Cancer Cell | 北京大学詹启敏/王维虎发现肠道菌群介导的核苷酸合成减弱了直肠癌新辅助放化疗的反应
时间:2022-12-25 14:59:54 热度:37.1℃ 作者:网络
术前新辅助放化疗(nCRT)是局部晚期直肠癌(LARC)患者的标准治疗方法,但对异质性患者反应背后的介质知之甚少。
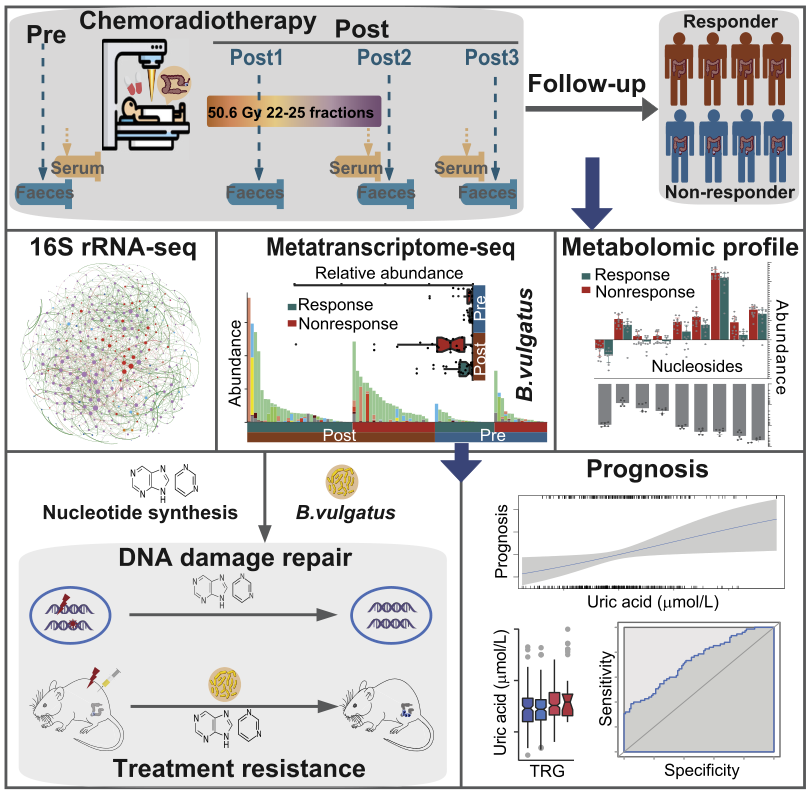
2022年12月22日,北京大学詹启敏及王维虎共同通讯在Cancer Cell(IF=39)在线发表题为“Gut microbiota-mediated nucleotide synthesis attenuates the response to neoadjuvant chemoradiotherapy in rectal cancer”的研究论文,该研究表明肠道菌群介导的核苷酸合成减弱了直肠癌新辅助放化疗的反应。在这项纵向研究中,作者对353份粪便标本进行了16S rRNA测序,发现nCRT后微生物多样性降低。多组学数据整合显示,Bacteroides vulgatus介导的核苷酸生物合成与LARC患者的nCRT耐药有关,无反应性肿瘤的特征是与DNA修复和核苷转运相关的基因上调。
5-氟尿嘧啶或放射治疗后,核苷补充或普通芽孢杆菌灌胃可保护癌细胞。对735例患者2205份血清样本的分析表明,尿酸是接受nCRT的LARC患者的潜在预后标志物。作者的数据揭示了肠道菌群介导的核苷酸生物合成在直肠肿瘤对nCRT的反应中的作用,并强调了在癌症治疗过程中破译癌细胞和肠道微生物之间的交叉对话的重要性。

直肠癌是世界上癌症相关死亡的主要原因之一,全世界每年有70多万新发病例被诊断为直肠癌,其中30%以上被诊断为晚期,生存期不利。新辅助放化疗(nCRT)伴全肠系膜切除术已成为局部晚期直肠癌(LARC)公认的标准治疗方法。然而,接受nCRT的患者中只有15%-27%达到病理完全缓解,20%-40%表现为很少或没有缓解。因此,迫切需要努力破译LARC对nCRT反应的机制。
放化疗结合放疗和化疗药物,通过破坏癌细胞的DNA来根除或控制癌细胞的增殖。双链断裂被认为是放化疗在细胞杀伤过程中引起的最致命的DNA损伤,癌细胞对放化疗的敏感性在很大程度上取决于它们对双链断裂的反应能力和修复DNA损伤的能力。DNA修复可以受到微环境中各种代谢线索的影响,这促使人们努力发现与放化疗反应相关的靶向性外部介质。作为宿主代谢的重要参与者,人类胃肠道腔内的共生微生物与宿主以互惠关系共同进化。
越来越多的证据表明,肠道菌群通过炎症和免疫反应与结直肠癌的发生和发展密切相关,其组成也被报道影响肿瘤对癌症治疗的敏感性。根据16S rRNA 扩增子测序,肠道菌群的组成也被报道与样本量有限的 LARC 患者对 nCRT 的反应有关。然而,对于这种肠道菌群改变对放化疗疗效的功能影响知之甚少,在现实世界的研究中,微生物改变治疗效果的精确分子机制仍然难以捉摸。
机理模式图(图源自Cancer Cell )
在这项纵向研究中,作者对126名中国LARC患者前瞻性收集的353份粪便标本进行了16S rRNA扩增子测序,以确定放化疗对应的菌群变化,并进行了元转录组测序、代谢物分析、并通过体外和体内功能验证,从肠道微生物源代谢产物的角度解读直肠癌细胞对放化疗反应的机制。


