Cell Stem Cell | 武汉大学张好建团队发现急性髓系白血病的潜在治疗新靶点
时间:2022-12-29 18:00:05 热度:37.1℃ 作者:网络
N6 -甲基腺苷(m6A)是一种常见的哺乳动物mRNA的化学修饰,在各种生物过程中表现出高度的动态。然而,m6A RNA甲基化组在白血病发生过程中的动态仍然未知。
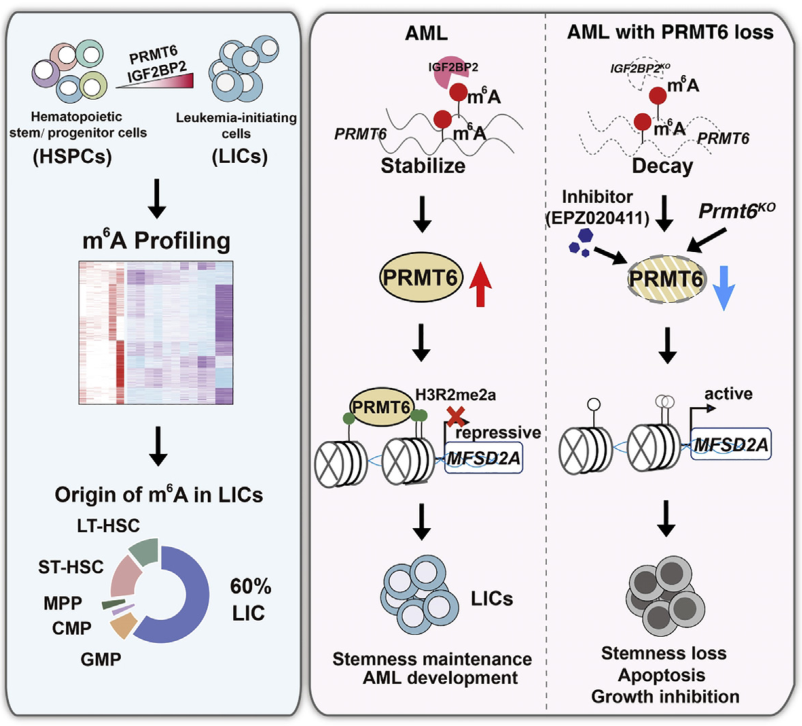
2022年12月26日,武汉大学张好建团队在Cell Stem Cell 在线发表题为“Decoding m6A RNA methylome identifies PRMT6-regulated lipid transport promoting AML stem cell maintenance”的研究论文,该研究表明解码m6A RNA甲基化组识别PRMT6调节的脂质转运促进AML干细胞维持。该研究描绘了急性髓系白血病(AML)发展过程中m6A的全面图景,并确定PRMT6是维持AML干细胞的关键。该研究观察到m6A甲基化组在白血病发生过程中发生了明显的变化,并发现蛋白精氨酸甲基转移酶PRMT6和m6A阅读器IGF2BP2维持了人和小鼠白血病干细胞(LSCs)的功能。PRMT6基因缺失或药理抑制会损害AML的发育和LSC功能。
机制上,IGF2BP2通过m6A介导的方式稳定PRMT6 mRNA,从而催化H3R2me2a并抑制脂质转运蛋白MFSD2A的表达。PRMT6缺失上调MFSD2A表达,增加二十二碳六烯酸水平,损害LSC的维持。总的来说,作者的研究结果揭示了PRMT6/MFSD2A信号轴在AML发展中的关键作用,并提供了一种靶向LSCs的治疗策略。

急性髓系白血病(AML)是一种致命的恶性血液病,其特征是低分化髓系细胞不受控制的扩张。AML的发展与造血干/祖细胞(HSPCs)中获得性遗传和表观遗传改变的积累有关,随后将HSPCs转化为白血病干细胞(LSCs),负责白血病的发生、进展和复发。尽管在AML发病机制的分子基础上取得了很大的进展,但在过去的30年里,成年AML患者的总体生存期并没有显著改善。因此,有必要进一步研究LSCs维持的分子机制,更好地了解AML的发展,为开发新的有效的治疗策略带来希望。
N6 -甲基腺苷(m6A)是哺乳动物mRNA上最丰富的修饰。这种可逆的修饰是由两个核心亚基甲基转移酶样3/14 (METTL3/METTL14)和其他亚基组成的甲基转移酶复合体安装的,并被去甲基化酶AlkB同源物5 (ALKBH5)或脂肪质量和肥胖相关蛋白(FTO)擦除。一般来说,m6A位点被不同的读本识别,如YTH结构域含蛋白1/2 (YTHDC1/ 2)、YTH结构域含家族成员1/2/3 (YTHDF1/2/3)和胰岛素样生长因子2 mRNA结合蛋白1/2/3 (IGF2BP1/2/3),它们在调控mRNA命运中起着不同的作用。
近年来,m6A在各种生理病理条件下的作用已被广泛揭示。一些研究表明m6A在正常和恶性造血中起着关键作用,包括AML这些工作为m6A修饰物作为AML治疗的潜在治疗靶点提供了理论依据。作者最近的工作描述了一个全面的造血系统的m6A景观,并发现m6A修饰在建立造血细胞状态中起着不同的作用。因此,解码白血病发生过程中m6A RNA甲基组的动态变化,并进一步探索LSCs与正常人之间m6A RNA甲基组的差异至关重要。
机理模式图(图源自Cell Stem Cell )
蛋白质精氨酸甲基转移酶(PRMT)家族成员通过催化组蛋白和非组蛋白底物精氨酸残基的单甲基化和对称或不对称二甲基化来调控许多蛋白质的活性。最近的研究表明,PRMTs在恶性血液病中起着至关重要的作用。PRMT1介导的FLT3甲基化有助于AML和混合系白血病(MLL)重排急性淋巴细胞白血病的维持。
PRMT5通过激活Wnt通路促进慢性髓系白血病(CML)中LSCs的生存和自我更新,同时也通过调节RNA剪接或调节E2F1甲基化来促进AML和jak2v617f骨髓增生性肿瘤的生存。PRMT7缺失可重编程甘氨酸代谢,生成甲基乙二醛,并损害cml中的LSCs。因此,靶向prmts可能是血液系统恶性肿瘤的潜在治疗策略。然而,PRMT6在白血病中的作用仍不明确。
在这项工作中破译了RNA m6A甲基化组在白血病发生过程中的改变,并发现PRMT6是AML发展和LSC维持的关键因素。该研究结果表明,PRMT6可能是AML治疗的一个有价值的治疗靶点。
原文链接:
https://doi.org/10.1016/j.stem.2022.12.003


