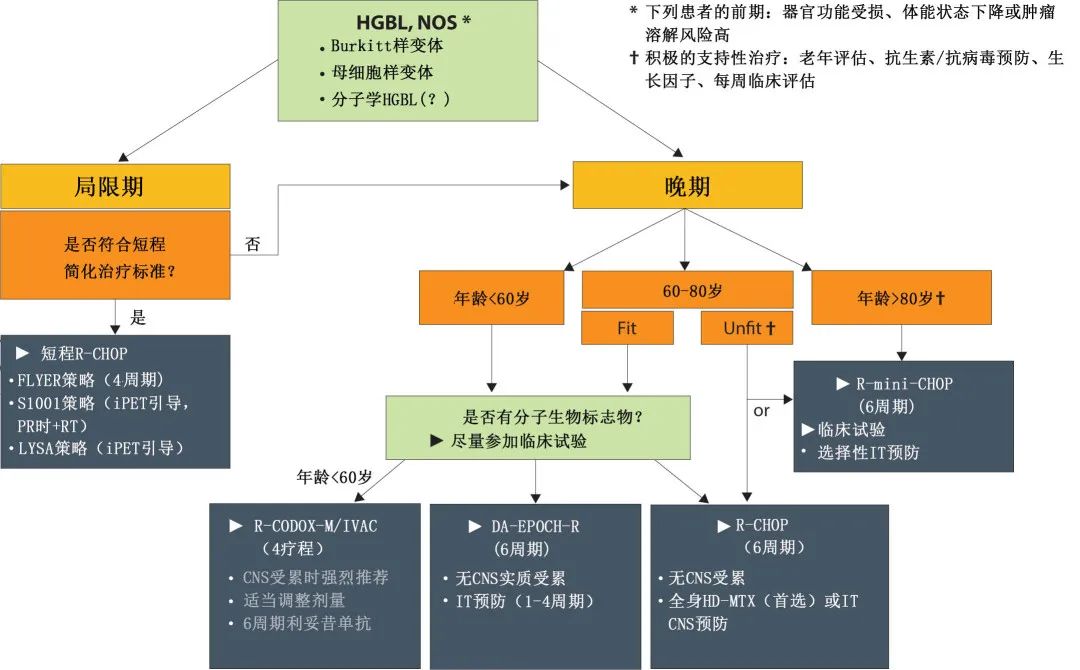
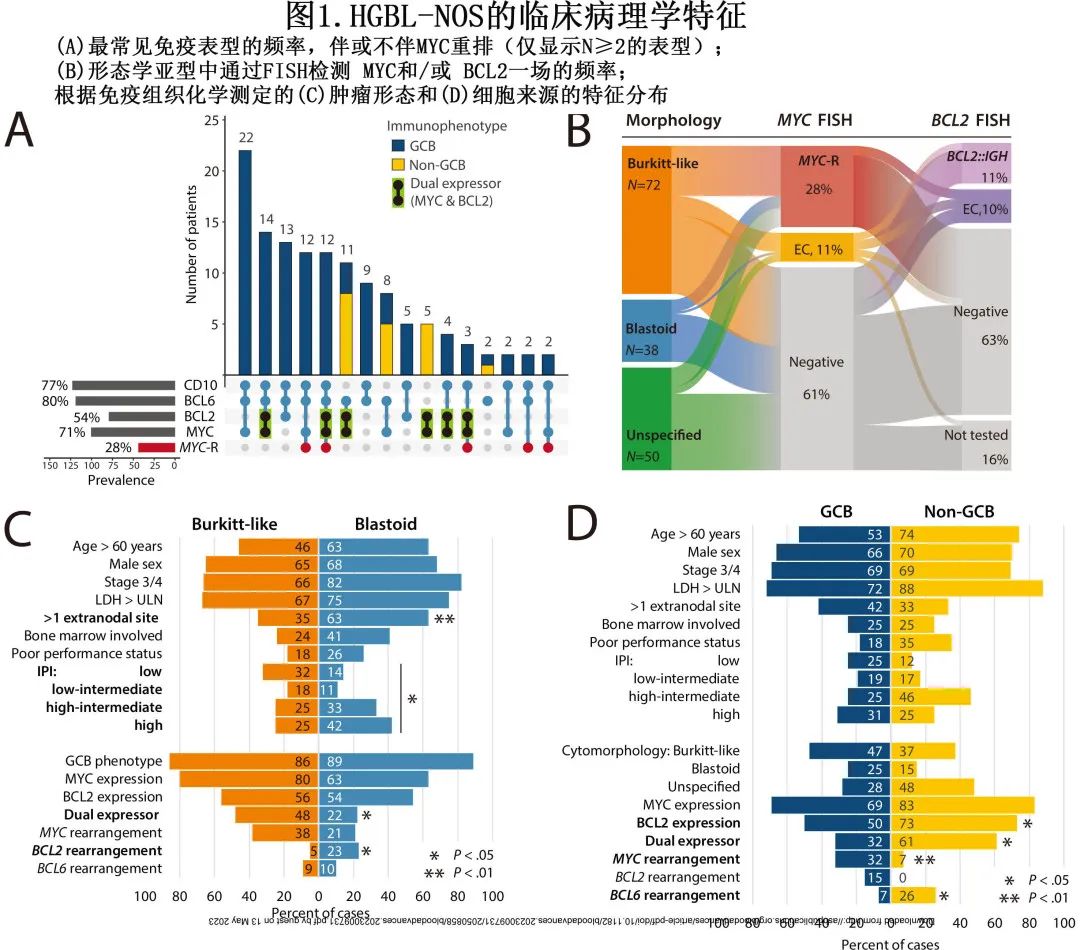
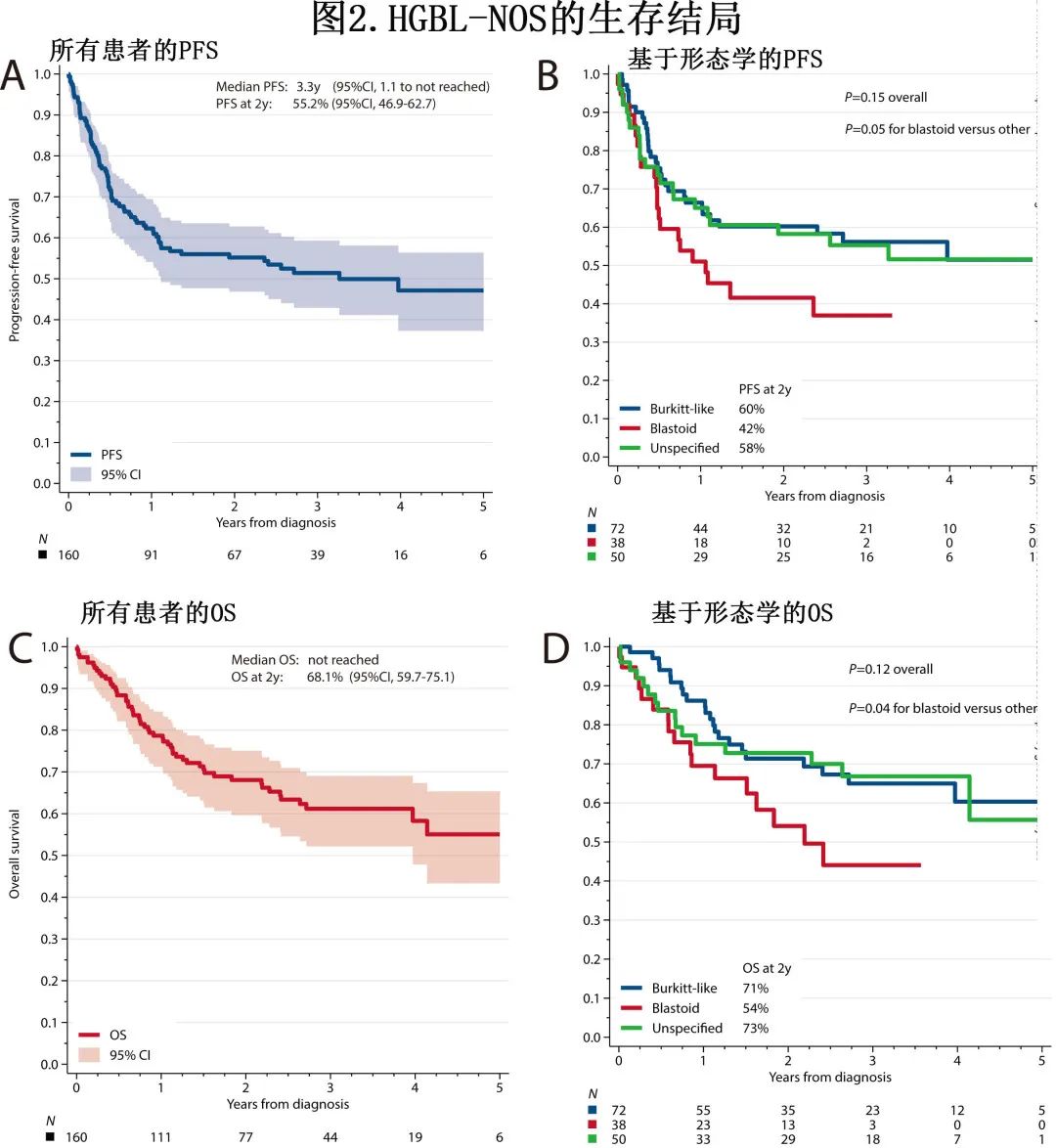
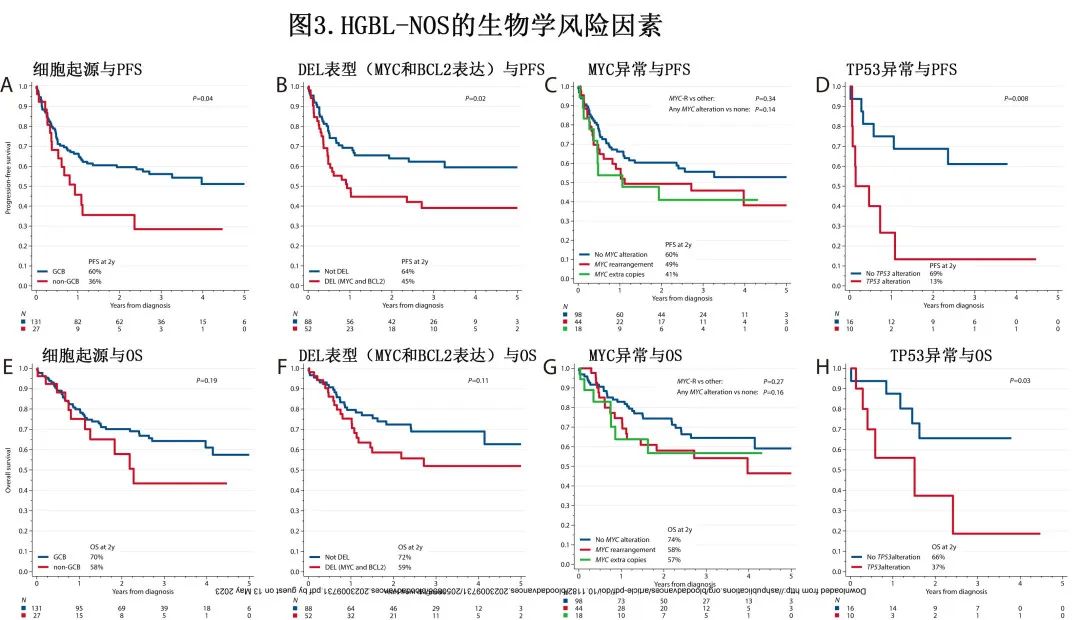
【Blood Adv】高级别淋巴瘤-非特指型的特征和结局:一项多中心回顾性研究
时间:2023-05-19 14:33:48 热度:37.1℃ 作者:网络
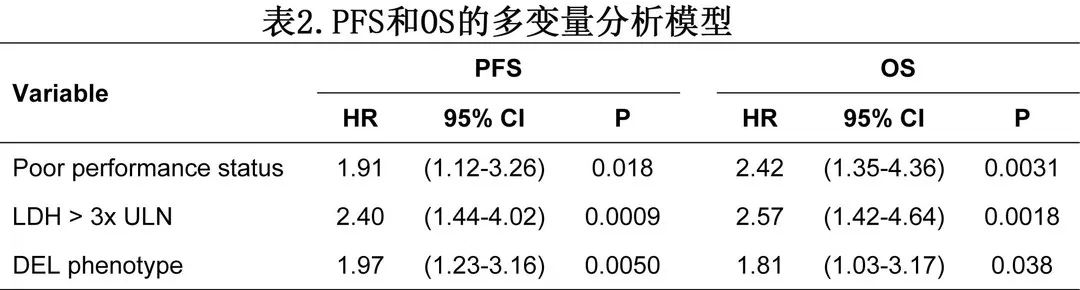
高级别 B 细胞淋巴瘤-非特指型 (HGBL-NOS) 是WHO第4修订版淋巴系统恶性肿瘤分类中引入的诊断类别,并在2022年 WHO 和国际共识分类 (ICC) 中均保留。该类别以及伴MYC和 BCL2 和/或 BCL6 重排的HGBL(通常称为“双打击淋巴瘤”)取代了之前的“B细胞淋巴瘤,不可分类,其特征介于弥漫性大B细胞淋巴瘤和 Burkitt 淋巴瘤之间”(BCLU)。HGBL-NOS 包括具有 Burkitt 样或母细胞样形态的淋巴瘤,但不包括双打击淋巴瘤、淋巴母细胞性淋巴瘤、母细胞样套细胞淋巴瘤或罕见的相关实体,如11q 畸变HGBL。 HGBL-NOS 肿瘤非常罕见,仅占 NHL 的1-2%,虽然它们与弥漫性大 B 细胞淋巴瘤 (DLBCL) 具有相同的特征,但对标准治疗的反应性和预后尚未得到专门研究。既往病例系列使用了较旧的 BCLU 名称且联合了HGBL-NOS 和双打击淋巴瘤病例,且来自单个机构的样本量较小,或缺乏一致的治疗和结局数据。 HGBL-NOS 并非精确定义的诊断类别,其定义依赖于形态学特征,包括 Burkitt 样和母细胞样变异,但排除双打击淋巴瘤后,它并不通过细胞遗传学或分子标志物定义。由于诊断材料有限,许多肿瘤可能归类为 “具有高级别特征” 的DLBCL,WHO将 HGBL-NOS 限制于绝对(但通常是主观)无法归入更具体诊断类别的罕见淋巴瘤。 由于缺乏对这种罕见亚型的前瞻性研究,HGBL-NOS的标准治疗也没有得到专门研究的支持,尽管许多专家基于各种高危 B 细胞淋巴瘤患者的单臂研究建议给予 R-CHOP 之外的强化化疗。 《Blood Advances》近日发表一项纳入160例HGBL-NOS患者的回顾性研究,旨在描述根据2016年 WHO 标准在美国学术中心诊断的 HGBL-NOS 患者的治疗和结局,并研究可能从强化治疗中获益的预后因素和潜在患者亚组。 下图为《Blood》2022年一篇文章中关于HGBL-NOS一线治疗的策略2,仅供参考。 作者回顾性分析了美国20家学术中心的160例新诊断HGBL-NOS成人患者,收集人口统计学、临床病理、治疗和结局数据。 患者和疾病特征 160例患者中位年龄为64岁,56%的患者诊断时年龄≥60岁(表1)。男女比例为2.1。4例 (2%) 患者感染HIV,CD4 计数介于100-524个细胞/mm3。患者多表现为晚期疾病:6%为3期,63%为4期。此外81%累及结外部位,包括骨髓 (24%)、外周血 (8%)、胃肠道 (22%)、肝脏 (12%)、肾脏 (13%)、性腺 (4%)、中枢神经系统 (CNS,7%)。大多数 (69%) 患者的血清 LDH 升高、国际预后指数 (IPI,54%) 为高或中高。9例为既往惰性淋巴瘤转化(6例滤泡性淋巴瘤和3例慢性淋巴细胞白血病),5例患者的 HGBL-NOS 为移植后淋巴增生性疾病(PTLD)。 形态学特征:Burkitt 样45%、母细胞样24%,不可分类31%。83%的病例为GCB免疫表型, 17%为non-GCB,2例未确定。排除数据缺失的病例,免疫表型分析显示,CD20 阳性率为96%,BCL6阳性率为80%,CD10阳性率为77%,MYC阳性率为72%,BCL2阳性率为54%,MUM1/IRF4阳性率为46%,CD5阳性率为14%(细胞周期蛋白 D1 免疫组化和FISH检测t(11;14) 均为阴性),CD30阳性率为7%(6/81)。中位 Ki-67 率为95%。37%存在 DEL 免疫表型,32%存在 Burkitt 样免疫表型 (CD10+/BCL6+/BCL2-)(图1A)。2例母细胞样病例 TdT 阳性,但其他为成熟 B 细胞淋巴瘤;两例均携带IGH::BCL2重排,1例由滤泡性淋巴瘤转化而来。EB 病毒编码的小 RNA(EBER) 原位杂交阳性率为8%(8/103)。 FISH 发现28%存在MYC-R,另外11%存在MYC-EC,13%存在BCL2-R(基于检测病例),12%存在BCL2-EC,11%存在BCL6-R,10%存在BCL6-EC(图1B)。9例行 FISH 检测 11q 畸变,且均为阴性。10/26例(39%) 有 TP53 异常。 根据形态学比较各HGBL-NOS亚型(图1C),母细胞样肿瘤比 Burkitt 样肿瘤更常累及多个结外部位(分别为63% vs.35%,P=0.005)、IPI总体较高(P=0.012)、更常携带IGH::BCL2重排(分别为23% vs. 5%,P=0.028),但DEL较少(分别为22% vs. 48%,P=0.016);MYC-R在 Burkitt 样 HGBL 中更常见(38% vs. 母细胞样21%,P=0.089),但 Burkitt 样 (CD10+/BCL6+/BCL2-) 免疫表型的频率差异无统计学意义(分别为37% vs. 35%,P =0.99)。此外,6例转化FL 病例中有5例为母细胞样,而所有 PTLD 患者均为 Burkitt 样形态。 所有形态学亚型中均以 GCB 免疫表型为主:Burkitt样中86%、母细胞样中89%和不可分类中74%。Non-GCB中 DEL 免疫表型(61% vs. GCB肿瘤32%,P=0.016)和携带BCL6-R(分别为26% vs.7%,P=0.022)更多,但很少有MYC-R(分别为7% vs. 32%,P=0.009;图1D). 未观察到接受 (N=97;61%) 或未接受 (N=63;39%)专家血液病理学审查的病例之间存在显著的临床或组织病理学差异。当6名专家血液病理学研究者检查15例特定病例的形态时,仅2例 (13%) 病例达到一致性,9例 (60%) 病例的形态分配获得>50%的病理学家同意。因此HGBL形态分配的评定者间可靠性非常差 (Cohen’s kappa =0.27) 治疗 在接受全身治疗的154例患者中,97%的患者接受利妥昔单抗作为初始化疗方案,其中43%的患者为DA-EPOCH-R,33%的患者为R-CHOP,7%的患者为R-CODOX-M/IVAC,4%的患者为R-hyperCVAD/MA。中位化疗疗程数为6。有数据的139例患者中57例 (41%) 接受了鞘内给药,26例 (19%) 接受了全身 CNS 预防(12%接受了两者)。144例有数据的患者中有20例 (14%) 接受了巩固性放射治疗,144例患者中有6例 (4%) 在首次缓解时接受了自体干细胞移植。与接受一线 R-CHOP 治疗的患者 (N=53) 相比, DA-EPOCH-R 治疗的患者 (N=68) 平均更年轻,更多为晚期疾病或 Burkitt 样组织学,但 MYC-R 频率无显著差异(分别为19%和31%,P=0.15)。 一线治疗的ORR为80.3%,CR率为69%。接受 R-CHOP 和更强化疗方案的患者在 ORR(分别为82% vs. 81%,P=0.99)或CR(66% vs. 74%;P=0.32)无统计学差异。59例 (38%) 患者 HGBL-NOS 复发,其中40例 (68%) 死亡。 最常见的二线治疗方案包括异环磷酰胺、卡铂和依托泊苷 (27%);地塞米松、大剂量阿糖胞苷和铂 (11%);吉西他滨和奥沙利铂 (11%)。85%的挽救治疗方案包括抗 CD20 单抗。挽救治疗的 ORR 为33.3%,CR为9.8%;且在初次诊断后6个月内复发或进展的36例患者中缓解率更低(分别为ORR 13.9%,CR 5.6%)。13例患者接受了 CD19 CAR T 细胞治疗,7例 (54%)缓解,4例 (31%) CR;但对 CAR T 细胞治疗有反应的7例患者中有3例 (43%) 发生进一步进展。 生存和预后因素 从诊断开始的中位随访时间为2.9年,中位 PFS 为3.3年,2年估计值为55.2%,3年估计值为51.4%(图2A)。大多数进展事件发生在早期,中位诊断后5.3个月。各形态学亚型之间无统计学显著差异,但母细胞样患者的结局稍差(图2B)。59例复发中的16例 (27%) 累及CNS。中位 OS 未达到,2年 OS 估计值为68.1%(图2C),且母细胞样 HGBL 更差(图2D)。进展后 OS 较差,中位7.3个月,2年 OS 为18.2%。 在单变量分析中,PS较差、晚期疾病、骨髓受累、LDH升高、non-GCB免疫表型、DEL免疫表型或表达 BCL2的患者 PFS 明显更差(图3A-B)。MYC-R 或 MYC-EC 不会导致PFS 无关统计学变差(图3C),而 TP53 异常或过表达呈现特别差的预后(图3D);此外存在 BCL2 或 BCL6 重排或 EC 时 PFS 也更差。IPI 与较差的 PFS 相关,但年龄校正的 IPI 或 Burkitt 淋巴瘤 IPI 区分能力更强。接受或未接受专家病理学审查的病例之间的结局无显著差异。对于OS的单变量预后因素相似,但按细胞来源、BCL2表达或 DEL 状态的差异未达到统计学意义,而BCL6重排/EC无预后意义(图3E-H)。研究者认为70%的死亡与淋巴瘤相关,7%是由于治疗毒性。 在多变量分析中,与 PFS 和 OS 最稳健相关的3个独立因素为:PS较差、LDH> 3×ULN和 DEL 表型(表2)。由于缺失数据的程度较高,TP53未纳入多变量模型中,但在校正其他因素后,其在检测患者中保留了 PFS 的预后意义。 根据一线治疗分析生存结局,发现接受 R-CHOP和更强化方案治疗的患者之间无显著差异(图4A/D)。考虑到样本量非常小和选择偏倚的可能性较高,难以解释接受 R-CODOX-M/IVAC 或 R-hyperCVAD/MA 的患者的不同结局,但R-CHOP 和 DA-EPOCH-R 治疗之间确实没有特异性的显著差异,即使进一步按下列因素分层:MYC-R(相互作用的P=0.55;图4B/E)、年龄调整的IPI(P=0.30)或在校正了多种预后因素的多变量模型中(N=121;PFS的校正风险比=0.76,P=0.38)。除了一个因素外,没有因素可以辨别 R-CHOP和DA-EPOCH-R 之间的不同结局:在一项排除转化淋巴瘤和 PTLD 的探索性分析中 (N=112),化疗方案和 Burkitt 样形态之间存在显著的相互作用(相互作用的P值=0.022);在 Burkitt 样肿瘤中,DA-EPOCH-R显示出 PFS 优势(P=0.027;图4C),按年龄校正的 IPI 分层后维持该优势(P=0.017),但OS 差异无统计学意义(P=0.23;图4F). 本研究描述了在学术实践中使用 WHO 分类标准诊断的 HGBL NOS 患者的特征、治疗和结局,从所有角度说明了罕见 HGBL-NOS 类别的异质性,且HGBL-NOS 患者的生存结局比历史报告的 DLBCL 患者更差。DEL 免疫表型与较差的 PFS 相关,但 MYC-R 与之无关。除新发 Burkitt 样亚组外,临床实践中常用的强化治疗方案似乎未显著改善结局。本研究的发现强调了未来研究更好地定义和专门管理这些侵袭性淋巴瘤的必要性。 作者认为,HGBL-NOS 患者应入组DLBCL、NOS试验,尤其是分子或细胞遗传学生物标志物驱动的试验。只有一半的患者可存活3年无进展,GCB HGBL(现在可以通过 GEP 区分)和预后不佳的non-GCB 都需要确定新的治疗方案。此外检测 HGBL-NOS 的 TP53 异常可识别标准细胞毒化疗不良结局风险最高的患者 参考文献 1.Adam Stephen Zayac,et al. High-grade B-cell lymphoma, not otherwise specified: a multi-institutional retrospective study.Blood Adv . 2023 May 12;bloodadvances.2023009731. doi: 10.1182/bloodadvances.2023009731. 2. Adam J. Olszewski, Habibe Kurt, Andrew M. Evens; Defining and treating high-grade B-cell lymphoma, NOS. Blood 2022