Nat Commun:基于特异性DNA甲基化特征的机器学习模型实现脑膜瘤的准确诊断和复发预测
时间:2023-10-08 17:20:28 热度:37.1℃ 作者:网络
脑膜瘤(MNG)是中枢神经系统最常见的原发性肿瘤。根据世界卫生组织(WHO)的数据,2级和3级脑膜瘤的病例占20-30%,这些肿瘤在患者中估计的复发率为20-75%。此外,部分患者存在肿瘤转移的可能,甚至危及生命。但目前还没有广泛认可的治疗该疾病的方法。
脑膜瘤治疗进展的主要障碍之一是缺乏标准化的评估标准或足够的生物标记物来衡量临床试验的成功与否。近年来,基因组和表观基因组生物标志物的检测已成为肿瘤学的标准实践,并被证明对中枢神经系统(CNS)肿瘤的分类、预后和临床管理有价值。根据肿瘤组织DNA甲基化模式对脑膜瘤进行分层,已被证明是所有脑膜瘤亚型的独立和可靠的预后预测因子,并在回顾性和前瞻性队列中优于世卫组织单独的分级系统。
但这些组织学和分子特征取决于通过手术获得的脑膜瘤组织,这种方法对于手术无法达到的肿瘤,以及有并发症的患者或延迟的患者来说可能是不可行的。此外,多次手术取样是不切实际的。因此,开发微创或非侵入性方法来检测已建立或新的分子标志物,反映实时肿瘤生物学和行为是必要的。
近日,来自美国Henry Ford健康中心的研究人员中Nature Communications发表了题为“Detection of diagnostic and prognostic methylation-based signatures in liquid biopsy specimens from patients with meningiomas”的文章。基于液体活检(LB),研究团队探索识别了脑膜瘤患者血清中的独特DNA甲基化标记,使用人工智能创建了通用的模型,能够准确地将脑膜瘤与对照组和其他中枢神经系统实体瘤区分开来,并预测复发风险。该研究结果为采用抽血等非侵入性方法实施脑膜瘤术前检测和评估其复发风险预测奠定了基础,将对脑膜瘤患者的治疗和预后产生深远影响。

文章发表在Nature Communications
主要研究内容
血清cfDNA甲基化水平能够区分脑膜瘤与其他CNS实体瘤
研究团队分析了155例脑膜瘤患者血液(血清和血浆)和组织样本中的DNA甲基化水平,并与其他中枢神经系统肿瘤和非肿瘤实体进行了比较。经过分析,发现血清全基因组cfDNA甲基化水平仅能部分区分MNG与非MNG情况(图1a)。通过监督方法,研究团队鉴定了98个脑膜瘤特异性差异甲基化探针,可显著区分以上两组。值得注意的是,与对照组和非MNG样本相比,MNG血清中平均DNA甲基化水平显著降低(图1b)。
为了研究类似的监督方法是否允许肿瘤组织和液体活检甲基组之间的可转换性,研究团队比较了MNG和非MNG组织样本,并确定了脑膜瘤特异性探针的一个子集,其中一些DNA甲基化特征可以在血清甲基组中检测到,并可区分血清样本中的MNG和非MNG。

图1. 血清cfDNA甲基化模式和特征可区分脑膜瘤与其他中枢神经系统肿瘤。
d-MeLB模型能够独立于样本来源准确地对样本进行分类
研究团队鉴定了256447个肿瘤特异性CpG探针,称为脑膜瘤特异性差异甲基化探针(DMPs),并将MNG肿瘤组织和公开的非肿瘤对照样本(癫痫脑)数据作为构建诊断分类器的输入。在该算法中,经过筛选,研究人员获得了在脑膜瘤血清和组织样本之间具有高DNA甲基化水平相似性的DMPs,即类似甲基化探针(SMPs)。有趣的是,研究观察到SMPs将脑膜瘤组织样本与血清和血浆样本聚集在一起,并有效地将脑膜瘤与其他中枢神经系统实体区分开来(图1e)。通过基于血清的监督分析筛选这些SMPs,得到了一个适用于液体活检样本的DNA甲基化特征集。研究团队开发了基于脑膜瘤特异性DNA甲基化标记的机器学习模型d-MeLB(diagnostic-Meningioma Epigenetic Liquid Biopsy),其适合于使用液体活检或组织样本来诊断和预测脑膜瘤。
将d-MeLB模型在整个模型选择血清队列中的应用表明,其具有较高的分类准确率。值得注意的是,d-MeLB模型的制定并没有考虑到组织分类,也没有将组织样本纳入发现集或独立验证集。因此,预计组织应用将受到限制。为了解决这一局限性,研究团队使用d-MeLB特征作为一个简单的线性判别算法的系数,对由脑膜瘤和非脑膜瘤组成的基于组织的集合进行分类。最后,d-MeLB在一个独立队列分类的准确性为94.3%。
血清cfDNA甲基化与脑膜瘤不同的临床病理特征、预后和免疫成分相关
无监督聚类分析结果显示,在MNG血清标本中,存在具有不同cfDNA甲基化谱的4个主要k聚类(图2a)。对这些具有临床病理和分子特征的血清源分子群的注释表明,这种聚类独立于性别、年龄和种族,并富集了与MNG预后相关的特征。例如,与k1和k2相比,k3和k4在WHO的2级和3级类型富集,并在患者随访中证实复发。此外,通过基于cfDNA甲基化的反卷积分析,发现k4富含中性粒细胞特征,具有最高的中性粒细胞-淋巴细胞比率(NLR),并在分析中耗尽了大多数免疫细胞类型。相比之下,k1簇中性粒细胞减少,几乎所有免疫细胞类型(B和T细胞,自然杀伤和单核细胞)比例都增加。
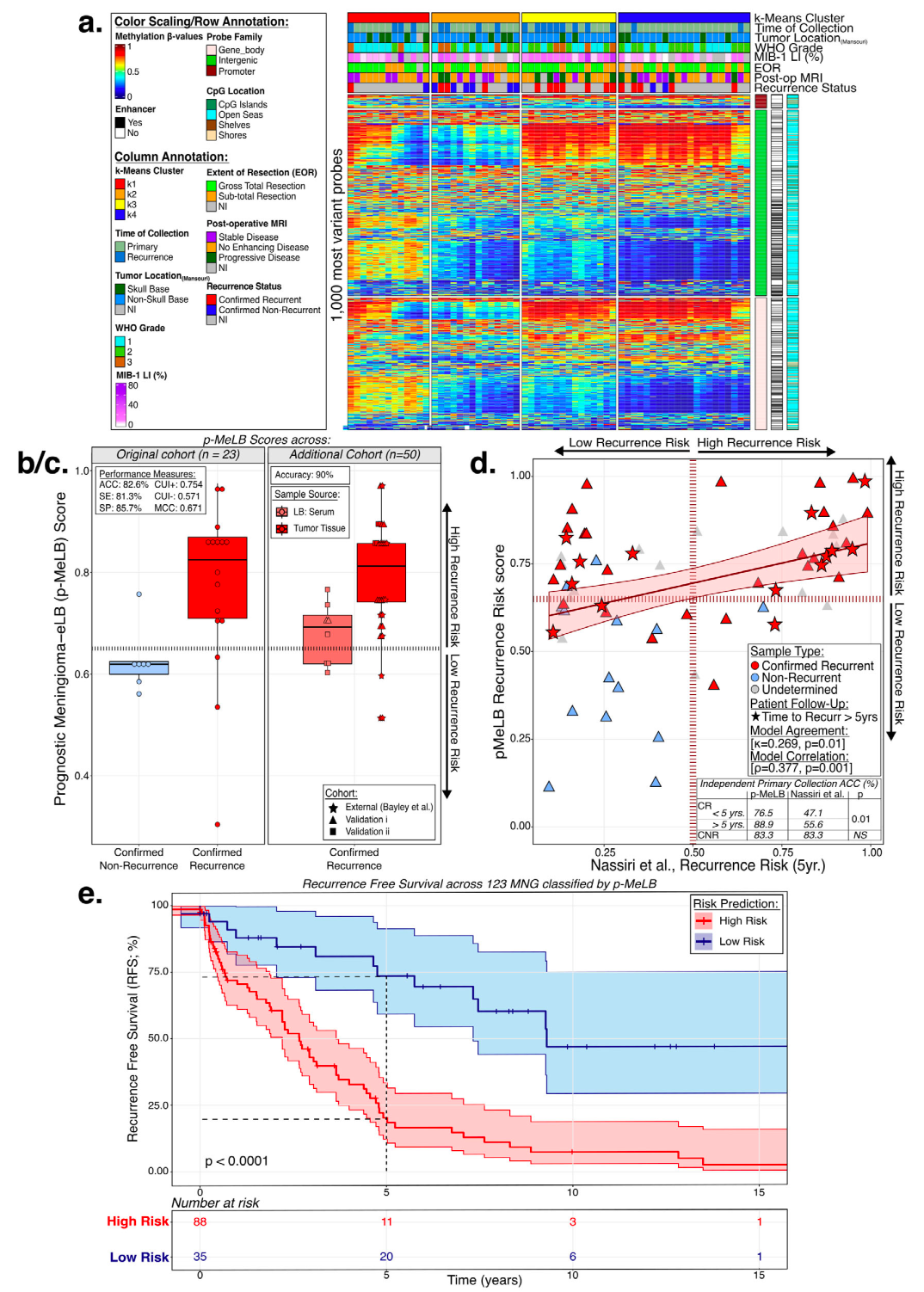
图2. 基于血清cfDNA甲基化模式和特征鉴别不同类型的脑膜瘤。
p-MeLB模型预测脑膜瘤复发风险
随后,研究团队构建了预后-脑膜瘤表观遗传液体活检(p-MeLB)模型,以使用血清或组织样本预测脑膜瘤的复发风险。结果显示,在独立验证的基于组织和液体活检的队列中,p-MeLB模型预测真实复发的的总体准确率为87.7%,性能验证结果令人满意,并在随访中得到了证实(图2b、c)。
紧接着,研究人员将p-MeLB模型应用于原发性脑膜瘤组织样本。有趣的是,在一个独立于p-MeLB模型衍生的主要MNG子集中,p-MeLB对预测随访中证实的真实复发表现出更高的敏感性。
p-MeLB模型在外部脑膜瘤组织队列中得到验证
为了进一步评估p-MeLB模型基于组织甲基化的预后分类器的性能。结果发现,p-MeLB复发风险预测与其他研究报道的预后和生存差异相一致。不过,由于缺乏足够的纵向信息,在这些外部队列随访期间,p-MeLB检测真实复发的能力的评估仍然是有限的。
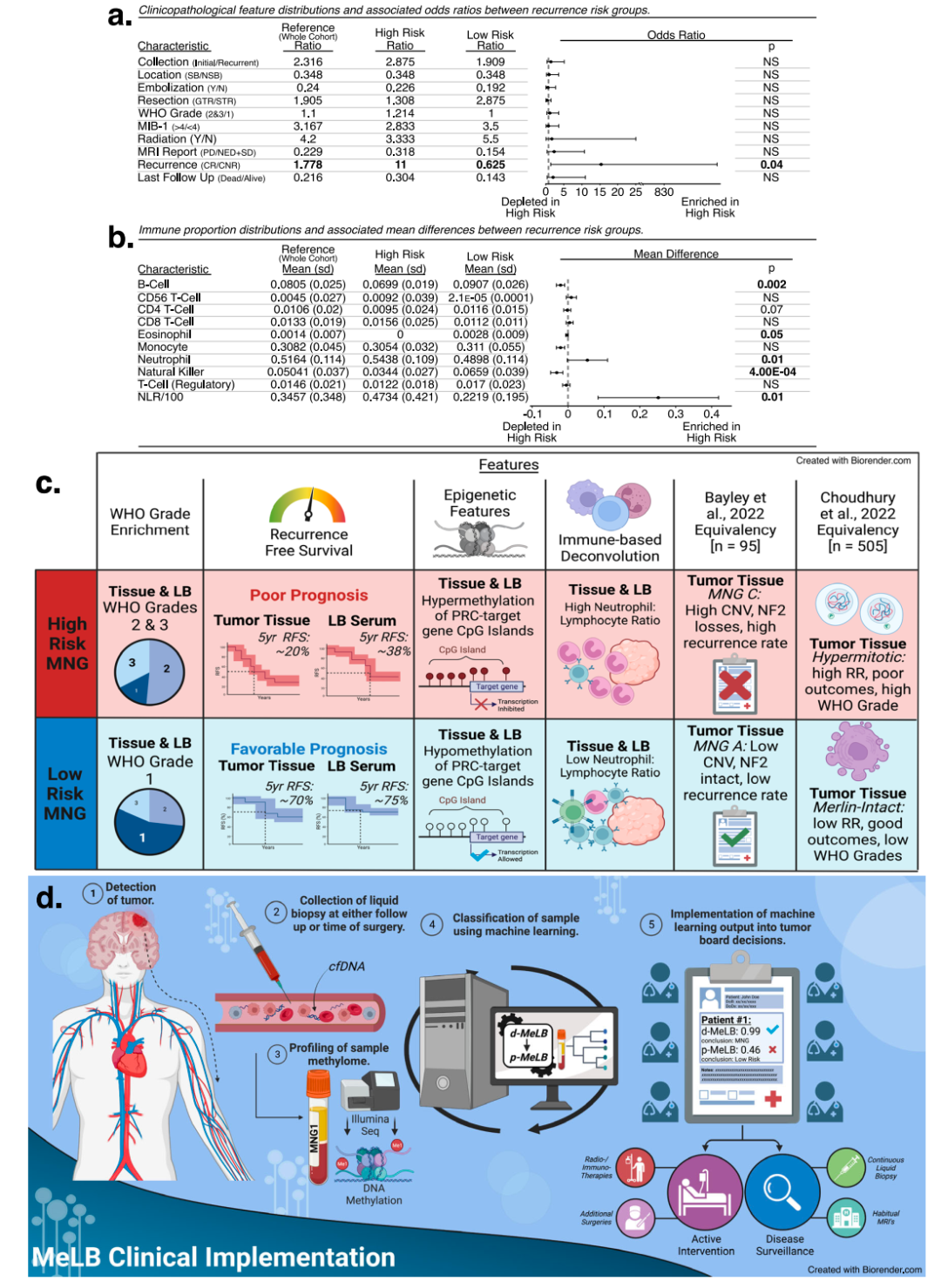
图3. p-MeLB预测脑膜瘤患者血清的临床病理和分子特征。
结 语
全基因组DNA甲基化评估为定义中枢神经系统肿瘤的离散分子群提供了一个客观、稳健和无偏倚的方法。在该研究中,研究团队利用脑膜瘤特异性DNA甲基化标记开发了机器学习模型,该标记适用于使用液体活检或组织样本诊断和预测脑膜瘤。该研究结果表明,基于血液样本,特别是血清,适合检测肿瘤特异性DNA甲基化特征,识别出的特征不仅能够区分脑膜瘤和其他颅内实体,在识别具有明显复发风险的脑膜瘤时也显示出准确性。因此,这些甲基化特征可能在随访中作为一种有价值的监测工具来检测脑膜瘤的复发,用于细化脑膜瘤的复发风险分层,并最终影响脑膜瘤患者的治疗和预后。此外,该研究提出的基于甲基组分析的机器学习分类方法,有潜力被扩展到使用液体活检进行更广泛的肿瘤诊断和预后。
参考资料:
Herrgott, G.A., Snyder, J.M., She, R. et al. Detection of diagnostic and prognostic methylation-based signatures in liquid biopsy specimens from patients with meningiomas. Nat Commun 14, 5669 (2023). https://doi.org/10.1038/s41467-023-41434-z.


