【Haematologica】AML中TP53突变单打击与多打击的预后影响
时间:2024-06-14 20:01:11 热度:37.1℃ 作者:网络
AML中TP53等位基因状态
TP53是恶性肿瘤中最常见的突变,与很多肿瘤的不良预后相关。例如在急性髓系白血病(AML)中,TP53突变(TP53MT)患者的中位总生存期(OS)仅有6-9个月。
单打击TP53MT与克隆性造血有关,一般不会直接导致白血病,除非伴随继发于细胞毒性应激的后续打击。在髓系肿瘤患者中,关于等位基因状态对预后的影响,特别是双等位基因异常/“多打击”(MH) TP53MT与单等位基因/“单打击”(SH) TP53MT的报道存在矛盾;在较低危骨髓增生异常综合征(MDS)中,与单打击相比,多打击TP53突变的预后较差,但在较高危MDS和急性髓性白血病(AML)中数据相互矛盾。
为了探索AML中TP53突变单打击与多打击的预后影响,学者回顾性分析了大样本TP53MT AML患者的数据,并报告了基于TP53等位基因状态的临床特征、治疗和结局。结果近日发表于《Haematologica》。

研究结果
基线特征
作者回顾性分析了美国10家中心的382例成人TP53突变AML患者,包括SH 139例和MH 243例。多打击TP53 突变的定义包括:(1) 检测到≥2个 TP53 基因变异,无论 VAF 如何;(2) ≥1个 TP53 基因变异与染色体 17p 的细胞遗传学异常(例如 17p 异常或17单体)同时发生;或(3) TP53 突变VAF≥55%。
243例MH TP53MT患者中包括:57例患者为多发TP53MT, 58例患者为TP53MT VAF≥55%, 128例患者为单个TP53MT合并17p染色体细胞遗传学(CG)异常 (如17p 异常或17单体)。SH和MH TP53MT AML组的中位年龄分别为67岁和66.5岁 (p=0.86)(表1),分别有39例(33%)和70例(29%)患者为继发性AML (p=0.34)。在109例继发性AML患者中,11例(10%)患者为存在JAK2突变的骨髓增生性肿瘤(MPN-BP), SH组和MH组分别有4例(3%)和7例(3%)(p=0.82)。SH和MH TP53MT AML组中位TP53MT VAF分别为22%和50% (p≤0.001)。MH组患者出现复杂CG的比例高于SH 组(93% vs 58%,p≤0.001)。在亚组分析中评估了IDH1或IDH2共突变AML患者的基线特征。数值上,继发性AML患者中发生IDH2突变的比例高于IDH1突变 (46% vs 27%,p=0.15)且复杂CG较高(54% vs 27%,p=0.24),但差异无统计学意义。
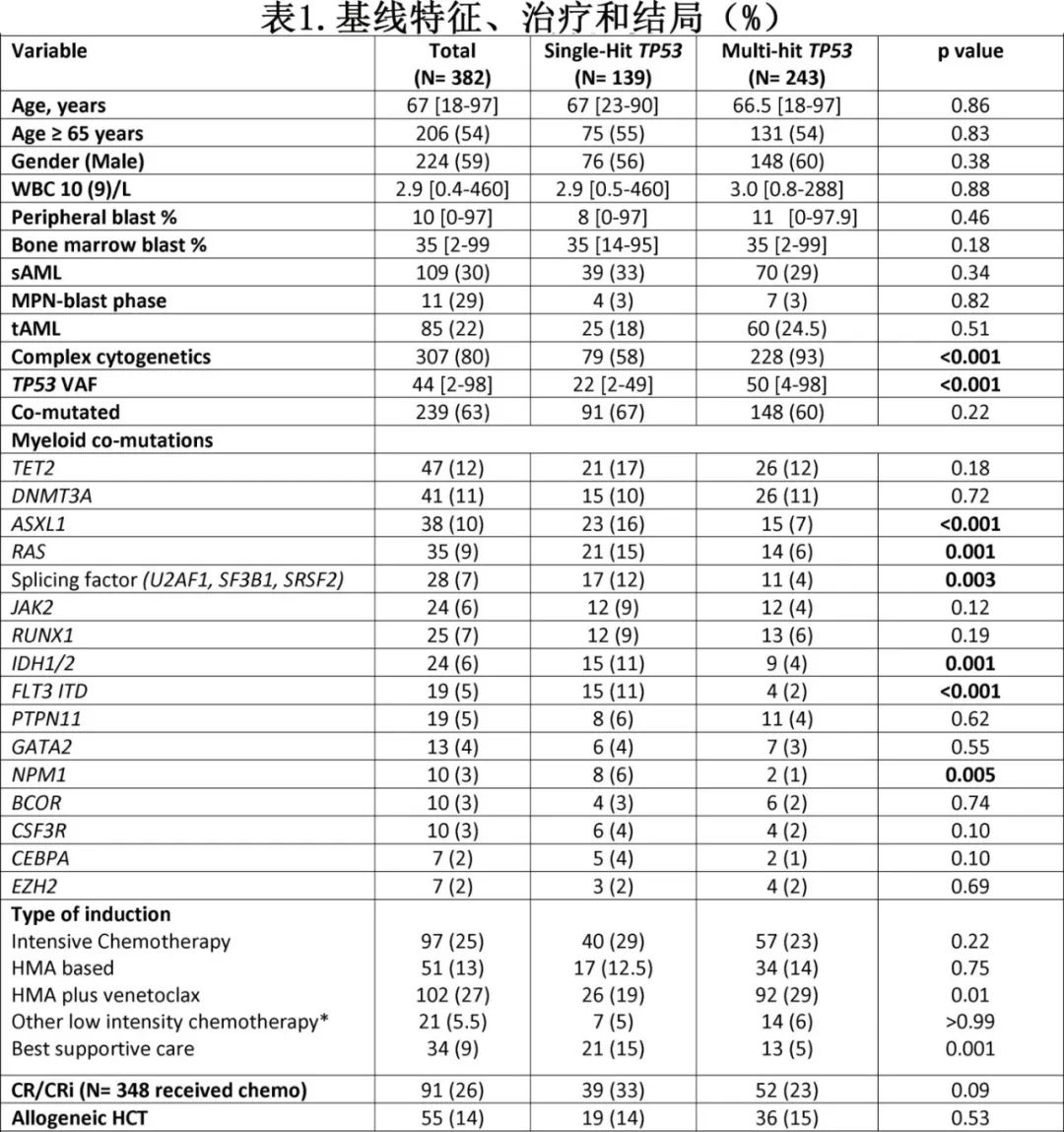
分子谱和体细胞共突变模式
TP53结构域的概述、TP53突变的分布以及在TP53蛋白上的位置见图1。SH组(67%)和MH组(60%)的体细胞共突变发生率相似(p=0.22)。ASXL1(16% vs 7%,p≤0.001)、RAS(15% vs 6%,p≤0.001)、剪接因子(12% vs 4%,p=0.003)、IDH1/2(11% vs 4%,p= 0.001)、FLT3-ITD(11% vs 2%,p≤0.001)和NPM1(6% vs 1%,p=0.005)突变在SH组高于MH组。
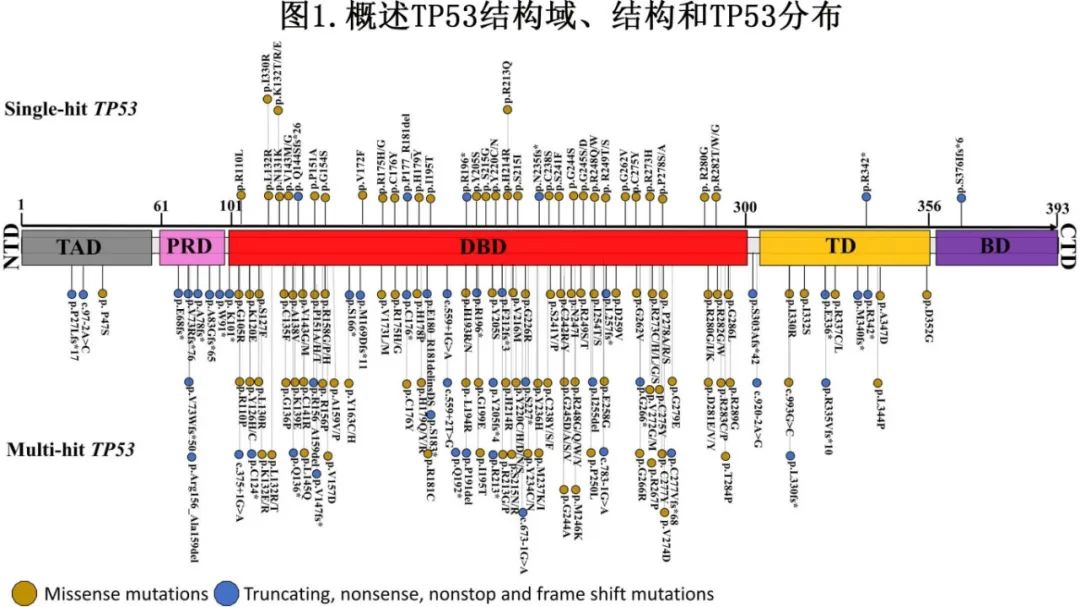
SH组和MH组的体细胞共突变模式和共突变频率见图2。11例(46%)患者携带IDH1突变,13例(54%)患者携带IDH2突变;IDH1和IDH2突变患者中分别有2例(18%)和7例(53%)携带MH TP53MT。IDH1/IDH2共突变患者的共突变模式基本没有差异,但JAK2突变在IDH2共突变组更常见(38.5% vs 0%,p=0.04)。
治疗和结局
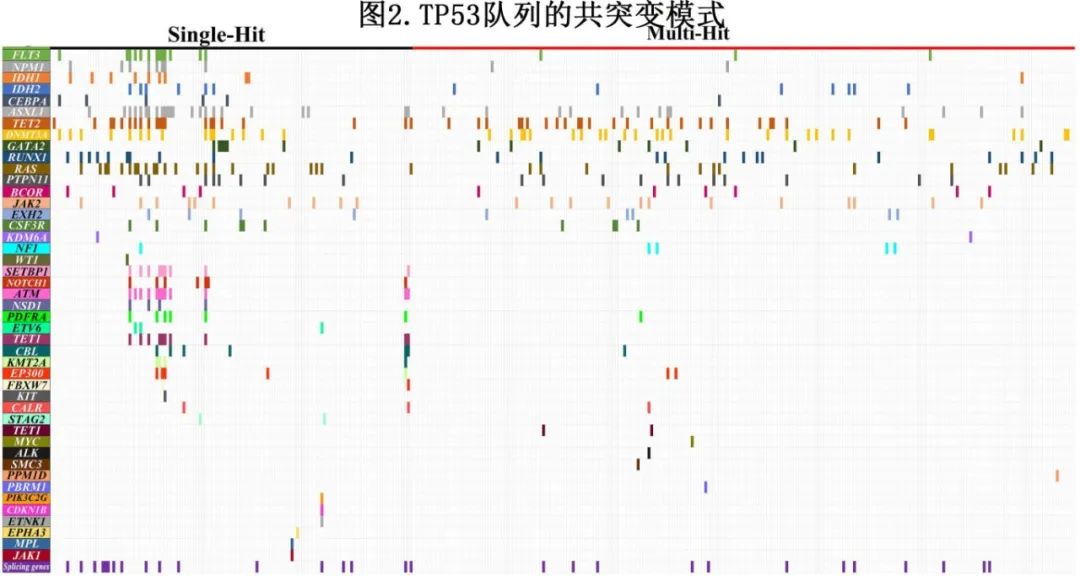
MH组患者接受去甲基化药物(HMA)加维奈克拉(VEN)的比例明显高于SH组(29% vs 19%,p=0.01),但接受强烈化疗、HMA治疗或其他低强度化疗(低剂量阿糖胞苷、IDH2抑制剂或研究药物)的患者比例相似(表1)。SH组和MH组之间的缓解率(CR/CRi)相似(28% vs 22%, p=0.21)。在CR/CRi患者(91例[26%])中,28例(31%)在诱导后流式细胞术检测的可测残留病(MRD)为阴性;强烈化疗与非强烈化疗的MRD阴性CR率无显著差异(10% vs 7%,p=0.78)。同样,诱导后接受异基因干细胞移植(allo-HCT)的患者比例也相当(12% vs 14%;p=0.53)。在亚组分析中,IDH1共突变患者(54.4%)和IDH2共突变患者(0%)的缓解率存在显著差异(p=0.003)。SH组和MH组的中位缓解持续时间分别为7.77个月和12.83个月(p=0.73,图3A)。
缓解的预测因素
RAS (NRAS或KRAS) (p=0.02)或IDH2突变(p=0.03)共突变对缓解率有负向影响,而同时发生IDH1突变(p=0.02)和HMA+VEN诱导(p≤0.001)与更好的应答相关。在该高危TP53MT AML队列中,年龄≥65岁(p≥0.99)、继发性(p=0.58)或治疗相关(p≥0.99) AML和复杂CG (p≥0.99)对缓解率没有显著影响。
无事件生存期(EFS)
考虑到SH组单纯接受支持治疗的患者比例明显高于MH组,将这些患者排除于生存分析之外。SH组和MH组中位EFS无显著差异(3.0 vs 2.20个月,p=0.22,图3B)。然而,如果按照ICC分类定义MH (2个不同的TP53MT伴VAF > 10%,或单个TP53MT伴17p缺失、VAF>50%;或TP53 17p位点的拷贝中性杂合性缺失),则SH组和MH组之间的EFS有统计学意义差异(3.0 vs 2.13, p=0.02)。在EFS的单因素分析中,复杂CG对结局有不利影响(p=0.04)。而在单因素分析中,ASXL1突变(p=0.02)、IDH1突变(p=0.01)、HMA+VEN诱导(p≤0.001)和allo-HCT作为时间相关协变量(p≤0.002)与有利EFS相关。在EFS的多因素分析中,IDH1共突变(HR=0.44,p=0.05)、HMA+VEN诱导(HR=0.53,p≤0.001)和allo-HCT (HR=0.34,p≤0.001)与有利结局保持显著相关。
总生存期(OS)
排除单纯接受支持性治疗的患者后计算中位OS。SH组和MH组的中位OS无显著差异(分别为8.50 vs 7.53个月,p=0.13,图3C),根据ICC分类定义MH后也未发现显著差异(8.0 vs 8.0个月,p=0.32)。评估SH和MH组复杂CG对OS的影响,SH和MH亚组无复杂CG(9.97和10.07个月)的OS优于复杂CG(6.2和7.13个月)(p=0.008,图3D)。从CR/CRi到末次随访或死亡进行界标分析;在SH组(未达到vs 9.63个月)和MH组(24.3个月vs 9.6个月),异基因HCT患者的OS均优于非异基因HCT患者(p=0.001[图3E])。在移植患者的另一个亚群分析中,MRD阴性CR移植患者(n=12)的中位OS数值高于MRD阳性CR移植患者(n=43)(46.1个月vs 25.47个月,p=0.15),但可能由于样本量较小而无统计学意义。对达到CR/CRi并接受异基因HCT的患者进行类似分析,以观察OS与复杂CG和TP53等位基因状态的关系,结果SH合并复杂CG、SH不合并复杂CG、MH合并复杂CG和MH不合并复杂CG患者的平均OS分别为23.6、未达到、20.2和未达到(p=0.18,图3F)。在SH TP53MT患者中,接受强烈化疗诱导的患者预后明显优于接受非强烈化疗的患者,中位OS分别为9.97个月和5.82个月(p=0.04)。但强烈化疗在改善MH TP53MT患者OS方面的获益不太明显,中位OS分别为8.03个月和6.7个月(非强烈化疗)(p=0.07)。
在OS的单因素分析中,年龄作为连续变量(每10岁)(p=0.02)、复杂CG (p=0.002)和其他低强度化疗(p=0.01)与不良预后相关。单因素分析显示,RUNX1突变(p=0.01)、IDH1突变(p=<0.001)、FLT3 ITD突变(p=0.003)、NPM1突变(p=0.02)、强化诱导(p=0.007)和allo-HCT作为时间相关的共变量(p≤0.001)与良好OS相关。在OS的多因素分析中,复杂CG (HR=1.56,p=0.04)保留不利影响;而IDH1突变(HR=0.24,p=0.01)和allo-HCT (HR=0.28,p≤0.001)保持有利的显著性。
总结
作者利用来自10个美国学术机构的数据进行了深入分析,研究SH (n=139)与MH (n=243) TP53MT AML的分子特征和结局差异。复杂细胞遗传学(CG)在MH中比SH TP53 MT AML中更常见(p<0.001);而ASXL1 (p≤0.001)、RAS (p<0.001)、剪接因子(p=0.003)、IDH1/2 (p=0.001)、FLT3 ITD (p≤0.001)和NPM1 (p=0.005)突变在SH TP53MT AML中显著聚集。排除单纯接受最佳支持治疗的患者后,生存率令人沮丧,但在SH和MH之间没有显著差异(EFS:3.0 vs 2.20个月,p=0.22;OS:8.50 vs 7.53个月,p=0.13)。在多因素分析中,IDH1突变和异体造血干细胞移植作为时间依赖性协变量与较好的EFS (HR=0.44,p=0.05;HR=0.34,p<0.001)和OS (HR=0.24,p=0.01;HR=0.28,p<0.001)相关。而负杂CG (HR=1.56,p=0.04)保留对OS的不利影响。
总的来说,与MDS不同,该研究未发现SH与MH TP53MT AML患者的缓解率或生存结局有显著差异。为了更好地了解TP53等位基因状态对TP53MT AML患者预后的影响,还需要进行前瞻性研究。
参考文献
Badar T,et al.Prognostic impact of ‘multi-hit’ versus ‘single hit’ TP53 alteration in patients with acute myeloid leukemia: results from the Consortium on Myeloid Malignancies and Neoplastic Diseases.Haematologica . 2024 May 30. doi: 10.3324/haematol.2024.285000.


