北航牛旭锋/深圳先进院阮长顺AFM:生物启发骨骨膜一体化胶原蛋白支架促进骨再生的连续制造
时间:2024-07-21 12:01:00 热度:37.1℃ 作者:网络
生物启发的天然骨-骨膜一体化支架是修复骨缺损的理想选择,然而实现具有集成且稳定界面的梯度支架仍然是一个挑战。北京航空航天大学牛旭锋&中国科学院大学阮长顺开发了一种生物启发的骨-骨膜一体化胶原蛋白基支架,其中顶层为电纺胶原蛋白密集型支架,作为生物启发的骨膜(BP),以防止网状纤维组织的侵袭;底层为原位矿化胶原蛋白支架(IMCS),以促进成骨分化。由于采用了连续制造的3D打印和电纺技术,所开发的集成支架(BP-IMCS)由BP和IMCS组成,展现出了卓越的结构稳定性,是直接组合支架的十倍。此外,体内植入结果证实,BP-IMCS显著提高了新骨形成率,达到32.47%,优于单层结构,这得益于其矿化离子和生物启发结构的协同作用。因此,本研究提供了一种连续制造策略,实现了骨-骨膜结构的集成和界面稳定,为异质结构组织制造提供了新的解决方案。该研究以题为“Continuous Manufacturing of Bioinspired Bone-Periosteum Integrated Scaffold to Promote Bone Regeneration”的论文发表在《Advanced Functional Materials》上。

图1展示了BP-IMCS(生物启发的骨-骨膜一体化胶原蛋白支架)的连续制造策略和体内植入的骨修复效果。该策略通过结合3D打印和电纺技术制造出具有稳定双层结构的BP-IMCS,上层为电纺胶原蛋白密集型支架,模仿生物启发的骨膜以防止网状纤维组织的侵袭,下层为原位矿化胶原蛋白支架,以促进成骨分化。体内植入实验结果表明,BP-IMCS显著提高了新骨的形成,与单一层次的支架相比,由于其矿化离子和生物启发结构的协同作用,新骨形成率提高了32.47%,显示出更佳的骨修复效果。
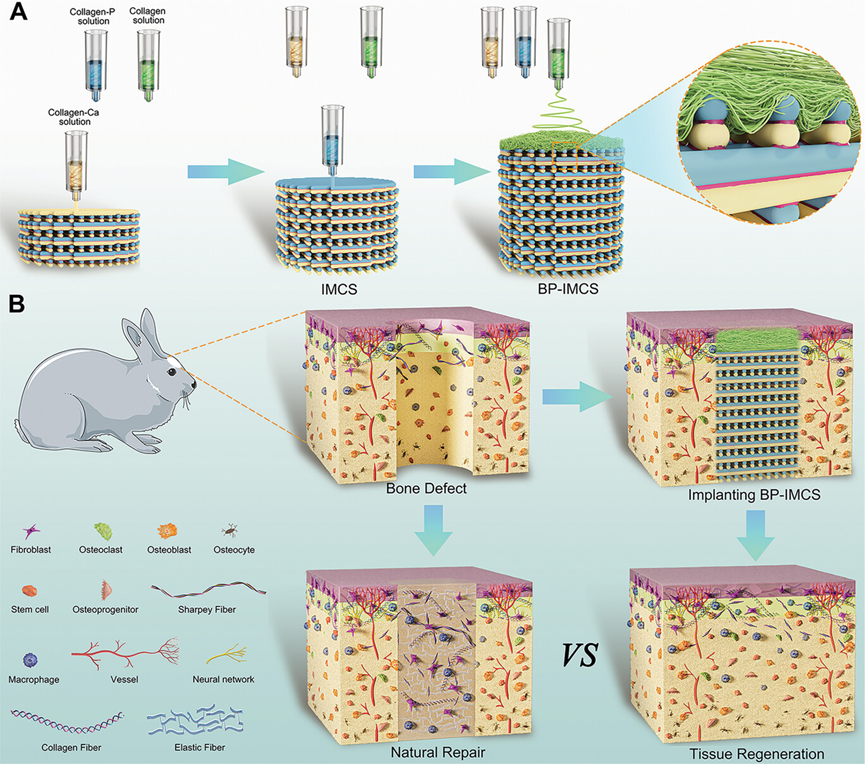
图1.BP-IMCS的连续制造策略和体内植入示意图
【BP-IMCS的双层结构与稳定性】
图2通过比较四种不同制造方法得到的双层支架在受到旋转振荡摩擦力作用时的界面粘结强度,发现BP-IMCS的界面结合力最大,其次是BP-D-IMCS,然后是IMCS-BP,而仅物理叠加的BP+IMCS粘结力最弱。BP-IMCS在相同的剪切应变下能承受更高的扭矩,其剪切应力要求达到4.33 ± 0.38 kPa才能开始界面分离,并且完全界面分离所需的剪切应力也是最大的,达到11.22 ± 1.62 kPa。这些结果表明BP-IMCS具有良好的界面粘附力,在摩擦环境中能够维持结构稳定性。此外,BP-IMCS的顶层BP由电纺纳米纤维构成,展现出光滑完整的形态和密集的孔隙结构,有助于维持早期阶段的形态并防止崩塌,而底层IMCS具有更大的孔隙和预设计的堆叠形状。电纺纳米纤维与3D打印纤维在两部分的界面紧密结合,进一步表明了BP-IMCS的卓越结构稳定性。
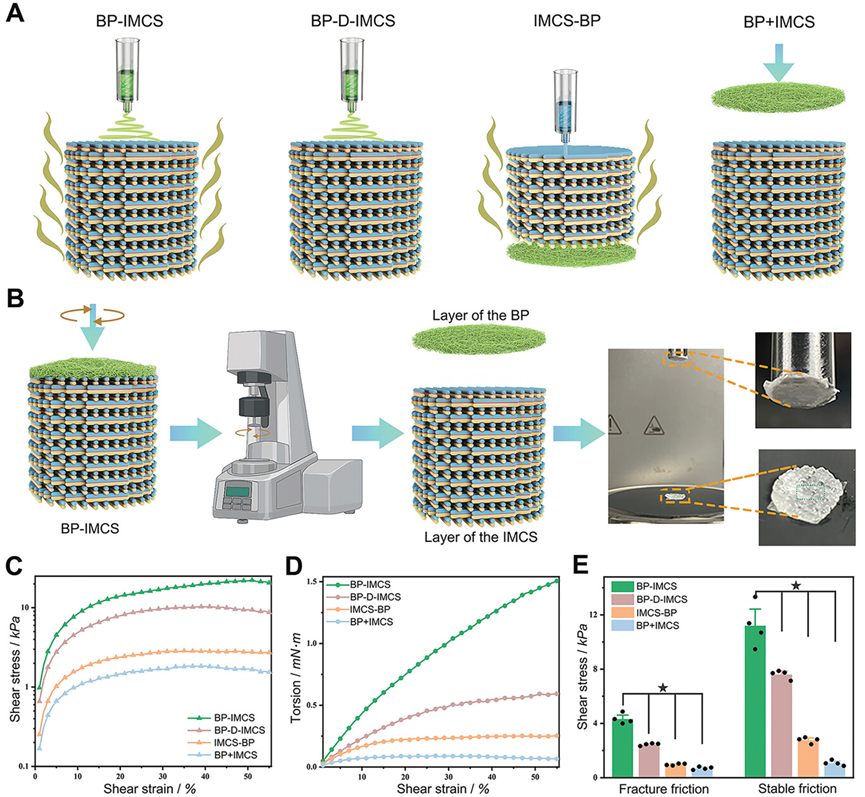
图2.连续制造的BP-IMCS双层结构的稳定性
首先,展示了BP-IMCS的界面、顶层和底层的形态,B部分通过共培养真皮成纤维细胞(DFs)验证了BP防止成纤维细胞向下侵袭的功能,而IMCS部分则通过共培养骨髓间充质干细胞(BMSCs)展示了促进成骨分化的功能。此外,还展示了DFs在BP和IMCS上的细胞活性和数量,结果表明BP的细胞活性优于IMCS,这可能受到两种支架结构和形态的影响,且细胞数量与细胞活性大致相似。这些结果表明BP能有效防止DFs的向下侵袭,而IMCS允许DFs通过孔隙从顶层迁移到底层。
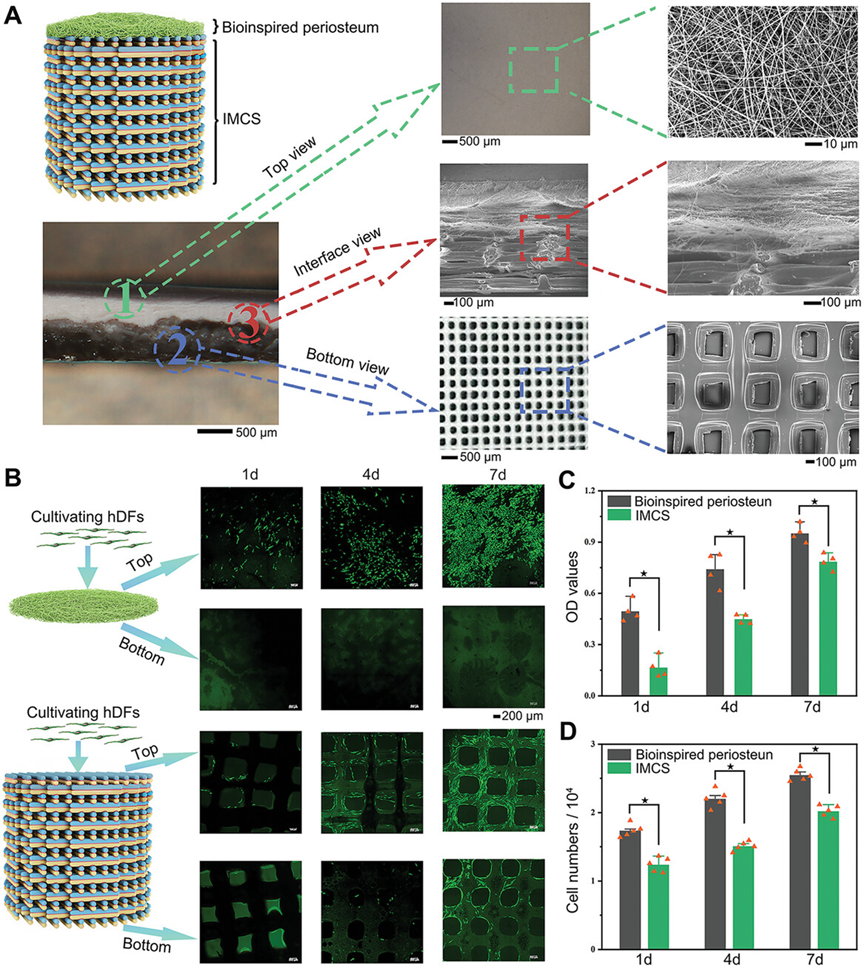
图3.BP-IMCS的形态和功能
【3D原位胶原蛋白支架的特性】
图4展示了3D打印胶原蛋白基支架的特性。首先,描绘了胶原蛋白基生物墨水的剪切变稀特性和液固转变时间,显示添加矿物质离子改善了生物墨水的打印性能。进一步证实了添加钙和磷离子的生物墨水延长了液固转变时间,表明离子溶液延迟了3D打印纤维的形成速度。此外,通过扫描电镜图像展示了IMCS中Ca和P元素的均匀分布,与仅在某些区域显示矿物质元素的HACS形成对比。用星形、花朵和圣诞树三种打印模型测试了IMCS对角或圆形结构的保真度。热图分析显示了3D打印纤维的高度连续性和平整性。表面算术平均高度分析表明,IMCS显示出最低的值,显示了原位矿化显著降低了支架的表面粗糙度。应力-应变曲线、拉伸应变、断裂伸长率和拉伸模量等力学特性测试结果表明,添加矿物质的支架(如IMCS和CaCS)相比于CS和HACS展现出更高的拉伸应变和拉伸模量,而HACS则展现出最高的拉伸强度和断裂伸长率。这些结果表明,添加矿物质离子可以增强胶原蛋白基支架的打印性能和力学性能,对于成功3D打印IMCS至关重要。
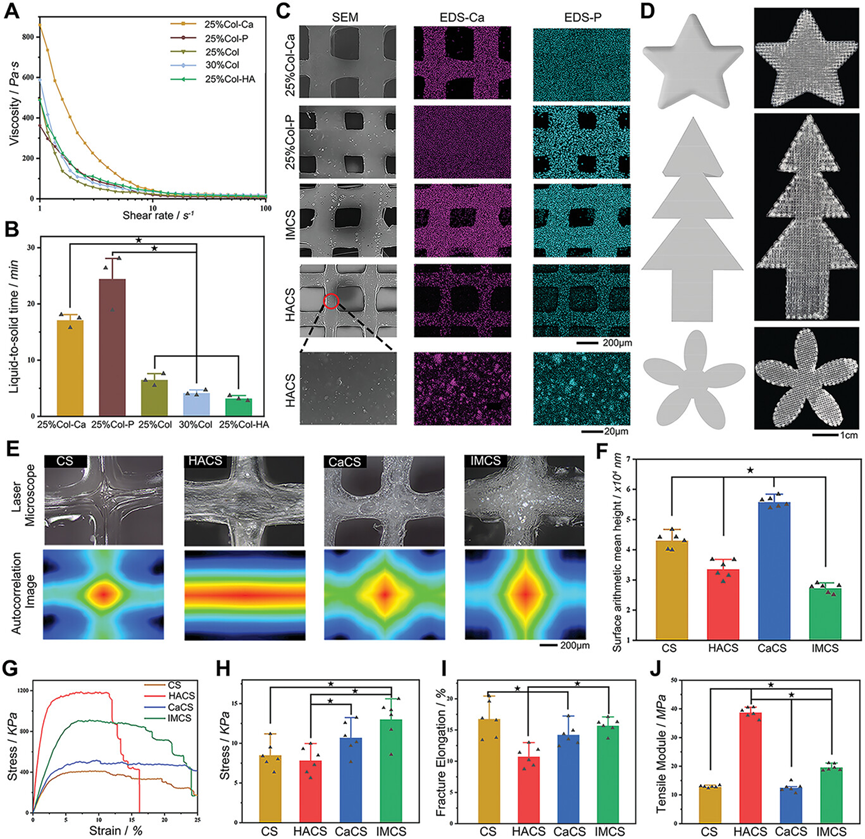
图4.基于胶原蛋白的3D打印支架的特性
【胶原基支架的细胞相容性和成骨分化】
图5展示了BMSCs(骨髓间充质干细胞)与胶原蛋白基支架共培养后的细胞相容性和成骨分化能力。活/死染色图像和细胞活性显示IMCS(原位矿化胶原蛋白支架)具有极佳的细胞相容性,几乎所有的BMSCs都存活。共培养7天后,IMCS上的BMSCs沿3D打印纤维生长,展现出明显的轮廓,而HACS(纳米羟基磷灰石胶原支架)上的BMSCs数量明显少于其他三种支架。ALP(碱性磷酸酶)活性和ALP染色图像表明IMCS在促进BMSCs成骨蛋白活性方面表现最佳。共培养14天和21天后,所有支架上的ALP染色区域均有所增加,其中IMCS的改善最为显著,显示出多个矿化基质沉积的聚集区域。培养基的pH值、钙浓度和磷浓度在共培养过程中也进行了表征,IMCS在早期迅速释放钙和磷元素并维持高浓度。成骨分化相关蛋白的基因表达水平分析表明,IMCS在共培养过程中的OPN和OCN(骨钙素)表达水平在21天时与其他支架相比显示出显著差异,表明IMCS对BMSCs成骨分化具有最佳效果。
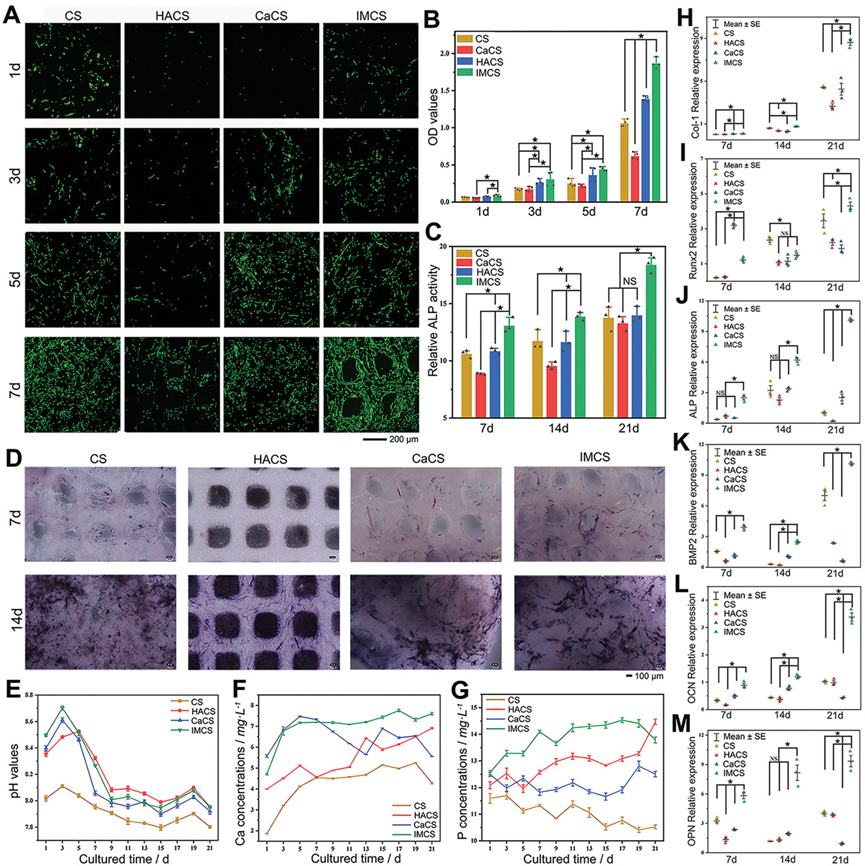
图5.胶原基支架的细胞相容性和成骨分化
【促进BP-IMCS的骨再生】
图6展示了BP-IMCS(生物启发的骨-骨膜一体化胶原蛋白支架)在体内植入后促进新骨生成的效果。通过显微CT图像和形态分析,研究者们定量和定性地评估了植入物在促进新骨形成方面的效果。结果显示,BP-IMCS在1个月和2个月时新骨体积/组织体积比(BV/TV)显著增加,分别达到12.78% ± 1.75%和32.47% ± 2.17%,明显高于其他组。此外,BP-IMCS在2个月时的骨小梁厚度(Tb.Th)最高,表明其在促进更有效的骨再生方面具有优势。骨小梁分离(Tb.SP)在BP-IMCS中显著增加,表明新形成的大部分是松质骨。骨小梁数量(Tb.N)在2个月时相对于1个月有所下降,而BP-IMCS显示出最高的下降幅度。各组间1个月时的各向异性(DA)值没有显著差异,但BP-IMCS在2个月时显示出最低的DA值,表明新形成的骨的形态与兔颅骨相一致,具有中间的松质骨区域和表面的皮质骨。此外,通过3D重建模型进一步验证了新骨的形成量,发现BP-IMCS在1个月时新骨量最大,而其他组如BP-HACS(含有上层BP和下层HACS的双层支架)只有少量新骨形成,空白组和IMCS组没有显著增加新骨。
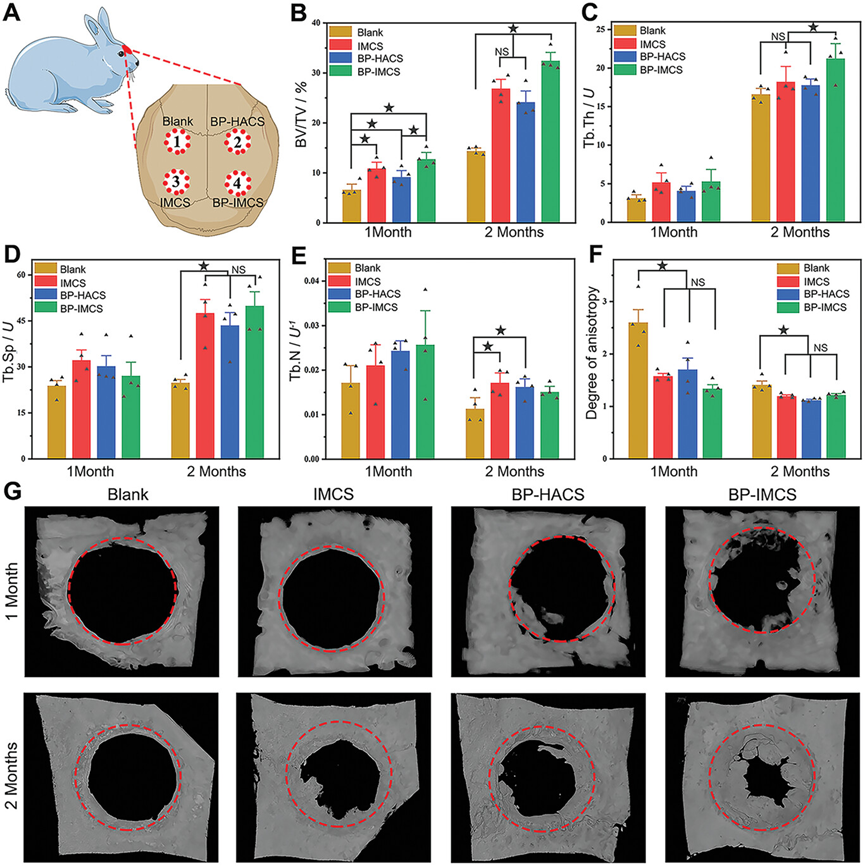
图6.体内植入后新形成的骨的显微CT图像和形态学分析
图7展示了BP-IMCS植入体内后在兔颅骨缺损部位新骨形成及防止纤维组织入侵的组织学染色结果。H&E染色和Masson染色用于分析新骨的形成情况,观察到空白组几乎未形成新骨,而BP-IMCS组在植入1个月后从缺损边缘向内显著生长新骨,2个月后新骨形成量最多,且在横截面上实现了缺损区域的愈合。此外,BP-IMCS相比IMCS组显示出更多的新骨形成,证实了BP在促进骨再生中的重要作用。尽管BP-IMCS和BP-HACS都含有BP,但前者在新骨形成效果上更佳,这可能是因为IMCS在成骨分化方面功能更佳。为了分析BP-IMCS防止纤维组织入侵的效果,使用弹力纤维、胶原纤维和网状纤维染色,结果显示空白组和IMCS组在植入1个月后观察到纤维组织入侵,而BP-IMCS和BP-HACS组未观察到纤维组织。2个月后,空白组仍然充满了大量纤维组织,而IMCS组的纤维组织消失。这些结果表明BP-IMCS通过防止网状纤维的入侵,维持了足够的空间以促进新骨的形成,从而在骨修复过程中发挥了协同作用,实现了更有效和更快速的骨再生。
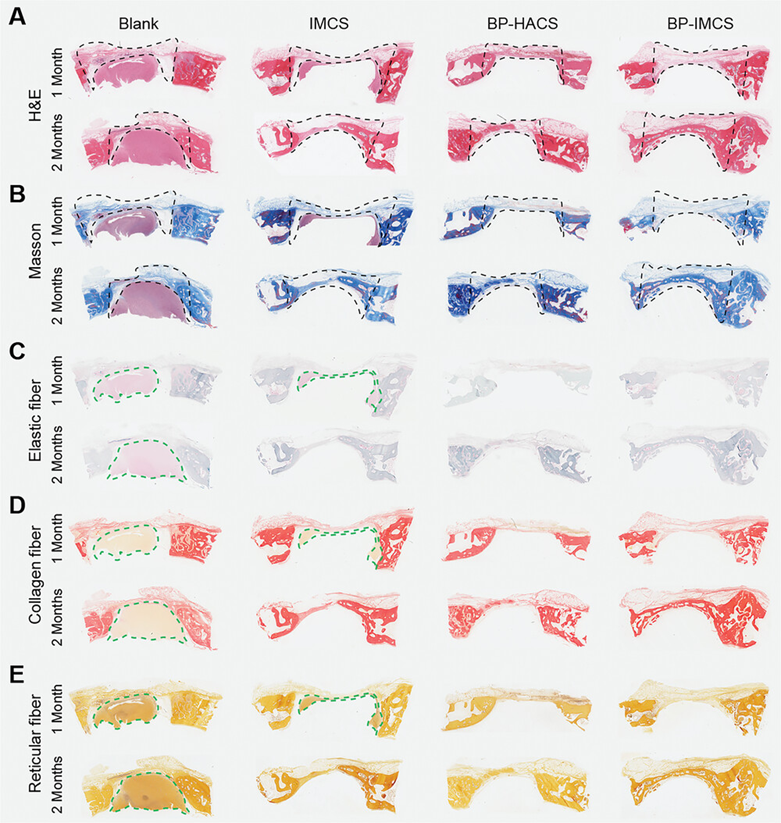
图7.兔颅骨缺损部位植入体内后的组织学染色
【小结】
该研究提出了一种连续制造策略,用于制造一种生物启发的骨-骨膜一体化的胶原蛋白基支架(BP-IMCS),以促进更快和更有效的骨再生。BP-IMCS通过顶层的生物启发骨膜(BP)防止网状纤维的侵入,并通过底层的原位矿化胶原支架(IMCS)促进成骨分化。这种连续制造策略增强了异质双层支架的结构稳定性,使其能够在植入后的摩擦环境中保持稳定,避免脱离。在植入颅骨缺损部位时,BP-IMCS的两部分协同作用,在2个月内形成大量新骨。这种生物启发的连续制造多组织策略不仅为组织工程领域提供了新的方向,而且为临床治疗提供了有力的支持。
原文链接:
https://doi.org/10.1002/adfm.202403235


