食管癌放疗联合免疫治疗后出现超进展,或与血小板减少症和JAK2拷贝数增加有关
时间:2024-07-30 16:00:33 热度:37.1℃ 作者:网络
放疗(RT)和免疫检查点抑制剂(ICI)是食管癌的重要治疗方法。一些研究证实了RT联合ICI的安全性和有效性,但也有一些患者表现出严重的毒副反应。本文报告了一例接受RT联合ICI治疗的转移性食管癌患者。患者出现严重的血小板减少,血小板生成素和皮质类固醇治疗无效。最后,患者在放疗区域外出现了远端转移。有趣的是,NGS检测显示手术切片中存在JAK2基因拷贝数增加。JAK2/STAT3通路参与调控巨核细胞的发育。复发性血小板减少可能会激活JAK2/STAT3通路,导致巨核细胞分化和血小板合成。然而,JAK2/STAT3通路的持续激活与免疫ICI耐药和肿瘤进展有关。本病例提示,血小板减少、JAK2基因拷贝数增加可能是ICI加RT治疗后预后不良的危险因素。
背 景
根据GLOBOCAN 2022估计,2022 年,食管癌是全球第 11 大常见癌症,也是全球第七大癌症相关死亡原因。根据临床分期和病理类型,推荐采用不同的标准疗法。对于早期食管癌,手术仍然是主要治疗方法,而对于局部晚期食管癌,放化疗是标准治疗方法。除了化疗(目前的标准一线治疗方法)外,还有几种FDA批准的靶向治疗药物可用于治疗晚期或转移性食管癌。
基于相关临床研究数据,免疫检查点抑制剂(ICI)目前被推荐作为晚期食管癌的一线和二线治疗方法。KEYNOTE181、ATTRACTION-3和ESCORT研究证实,与化疗相比,ICI治疗可延长晚期食管癌患者的总生存期(OS)。因此,根据 2021 年美国国家综合癌症网络(NCCN)和中国临床肿瘤学会(CSCO)指南,帕博利珠单抗、纳武利尤单抗或卡瑞利珠单抗联合化疗已被建议作为晚期食管癌患者的一线治疗方法,或单独作为二线治疗方法。尽管ICI治疗的副作用比化疗少,但免疫相关不良事件(irAE)并不少见,包括肺炎、肝炎、肾炎、内分泌疾病和血液毒性等。
放疗(RT)是可切除和不可切除食管癌的重要治疗方法。RT联合ICI治疗可能对肿瘤免疫反应产生协同作用。RT诱导肿瘤细胞凋亡,从而增加肿瘤抗原通过抗原呈递细胞(APC)的释放和交叉呈递。具体而言,RT增强炎症免疫反应,随后改善免疫抑制肿瘤微环境,最终增强ICI的疗效。一些研究证实了RT联合ICI的安全性和有效性。一项包括 11 项研究的荟萃分析显示,接受ICI联合RT治疗的患者的客观缓解率(ORR)和疾病控制率(DCR)优于ICI单药治疗的患者(42% vs. 15% 和 85% vs. 26%)。另一项包括 51 项研究的荟萃分析显示,ICI联合放疗与ICI单药的 3-4 级毒性相当(ICI联合放疗和ICI单药分别为 16.3% 和 22.3%)。即便如此,一些患者在接受ICI联合放疗后仍会出现严重的副作用或疾病进展(PD)。本文报告了一例罕见病例,放疗联合免疫治疗导致严重的血小板减少和超进展。
病 例
患者男,62 岁,因吞咽困难 2 个月于 2020 年 5 月就诊,经胃镜黏膜活检确诊为胸段食管鳞状细胞癌(ESCC)。患者主要诊疗过程如下图所示(图1A)。随后实施根治性食管切除术。病理检查证实为中低分化食管鳞状细胞癌,病理分期确定为T2N0M0 IB(图1B、C)。每 3 周给予 2 个疗程的辅助化疗,包括多西他赛(75 mg/m2)和顺铂(75 mg/m2)。随后出现 3 级骨髓抑制(主要为血小板减少),此时给予重组人血小板生成素(TPO)可迅速改善血小板计数。患者随后接受改良的第三轮化疗,包括多西他赛(75 mg/m2)和顺铂(75 mg/m2)。但患者再次出现严重血小板减少,停止化疗。2021 年 1 月,患者再次出现轻度吞咽困难,CT扫描显示肝脏和颈部淋巴结以及胃食管吻合口转移。由于在肿瘤组织中观察到PD-L1阳性表达(肿瘤细胞比例评分[TPS] 10%,综合阳性评分[CPS]的 20%)(图1D、E),考虑给予ICI。2021 年 1 月 31 日给予卡瑞利珠单抗联合顺铂(75 mg/m2)和5-氟尿嘧啶(400 mg/m2)治疗。不幸的是,患者出现 4 级血小板减少,经TPO治疗后痊愈。但由于血液学毒性复发,化疗不得不完全暂停。2021 年 2 月 14 日,患者开始接受每 2 周 200 mg卡瑞利珠单抗单药治疗。在此期间,患者的血小板计数正常。
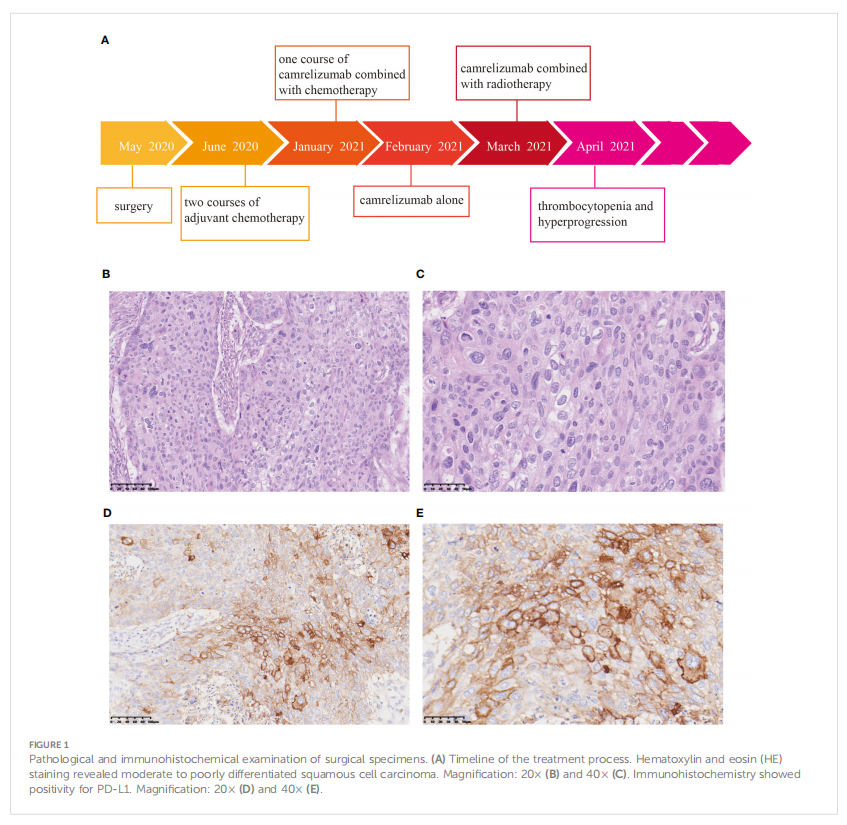
▲图1 手术标本的病理和免疫组织化学检查
然而患者出现进行性吞咽困难,需要进行症状缓解。吞咽困难的姑息治疗可以通过多种方式实现——食管支架置入和放疗。与患者沟通后,于 2021 年 3 月 11 日开始对颈部淋巴结和胃食管吻合口进行调强放疗(28 次,共 54 Gy)。接受ICI联合RT治疗后,血小板计数迅速下降(<25×109/L)(图2A),TPO无效。骨髓穿刺排除了中枢系统病因。不能排除卡瑞利珠单抗诱发的免疫性血小板减少症,当血小板计数降至 20×109/L时开始口服皮质类固醇(1 mg/kg/天)和TPO联合治疗。然而,患者的血小板计数没有恢复。
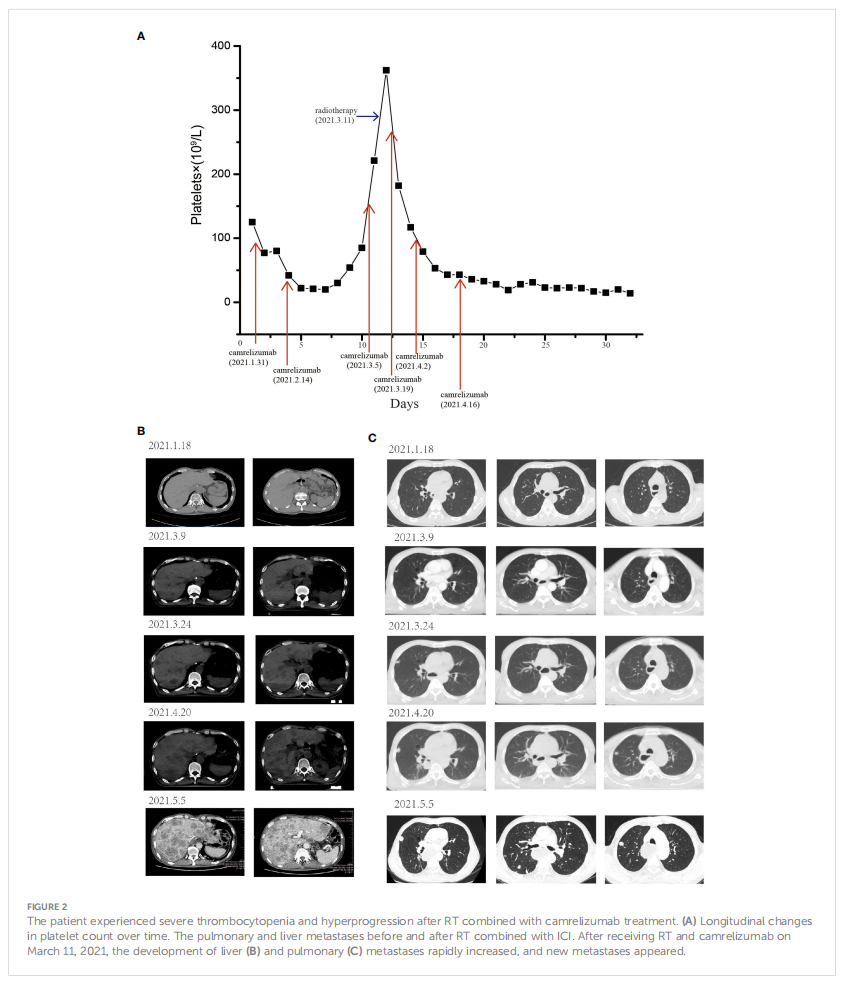
▲图2 HE染色和免疫组织化学结果,左为原发灶,右为肝脏病灶
患者因细胞毒药物的直接破坏作用而发生化疗引起的血小板减少,经TPO治疗后迅速恢复。然而,在RT和ICI治疗后,血小板计数持续下降,对TPO或皮质类固醇无反应。也可能发生由自身抗体异常激活导致的巨噬细胞介导的血小板破坏。通过免疫组织化学(IHC)和免疫荧光(IF)在手术标本中检测到丰富的CD68+巨噬细胞(图3A)。此外,为了分析潜在病因和预后,对手术标本提取的DNA进行了下一代测序(NGS)。研究人员发现TP53基因在p.L114A位点发生突变,同时KRAS和JAK2基因拷贝数增加(表1)。研究人员通过IHC和IF检测并确认了手术标本中肿瘤细胞中JAK2的阳性表达(图3B)。
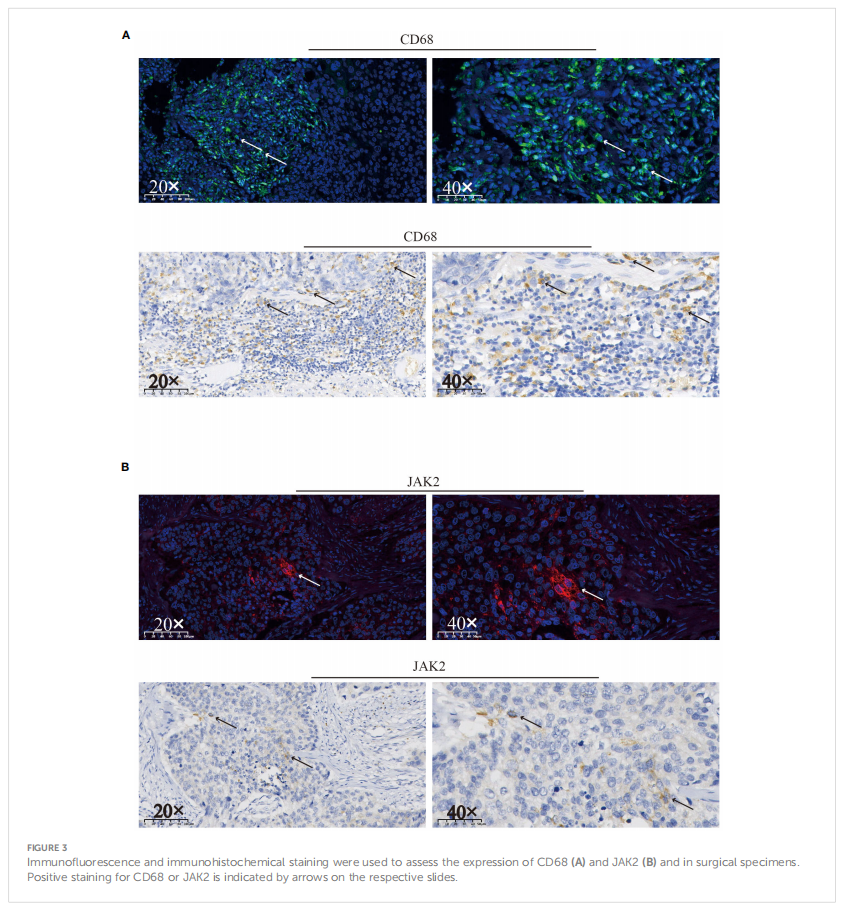
▲图3 免疫荧光和免疫组化结果

▲表1 NGS检测结果
患者吞咽困难经放疗后得到缓解,但CT扫描显示肺部出现一些新病变,肝脏出现转移,且病情逐渐进展。自 2021 年 4 月底以来,患者变得越发疲倦,并出现呼吸困难,病情进展迅速。2021 年 5 月 5 日,CT扫描显示肝脏弥漫性病变和肺部多发转移(图2B、C),最后患者因多器官衰竭而亡。
讨 论
众所周知,放疗与免疫系统相互作用。放疗会导致肿瘤抗原的释放,从而导致肿瘤抗原呈递增加,从而募集并激活抗肿瘤亚群,如CD4+和CD8+T细胞、细胞毒性NK细胞和CD8+CD56+NK T细胞。因此,低免疫原性的肿瘤微环境转变为免疫活性状态。相对的是,放疗也可以通过诱导耗竭信号(如PD-1和Tim-3)以及增加TGF-β(抑制T细胞活化并促进调节性T细胞发育)来消耗细胞毒性T细胞。因此,肿瘤细胞可以破坏免疫监视,最终导致放疗耐药。Loannis M Koukourakis报道了一名膀胱癌患者,在接受放疗联合抗PD-1免疫治疗后,在放疗区域外出现了远端超进展。在本文患者中,同时进行的放疗和每两周一次的抗PD-1治疗导致了远端肿瘤过度进展以及严重的血液学毒副作用。
部分接受ICI治疗的患者可观察到超进展。一些研究者将超进展定义为:①2 个月内治疗失败,②靶病灶增加>50%,③临床症状明显恶化,④或与最近一次扫描相比,出现 2 个或 2 个以上新病灶或新器官受累。ICI治疗期间发生超进展的病理生理机制包括对免疫治疗的原发性耐药、缺乏靶点、T细胞耗竭、促癌细胞的调节、异常炎症以及致癌途径的激活。一项回顾性研究表明,与进展组患者相比,在非小细胞肺癌患者中,超进展组在接受纳武利尤单抗治疗后,循环白蛋白显著下降,白细胞计数和c反应蛋白上升。然而,这些生物标志物是否能够预测超进展,仍需要更严谨的研究以及更多的观察和讨论。患者接受卡瑞利珠单抗联合放疗后病情迅速恶化,至治疗失败时间(TTF)小于 2 个月,放疗区域外病灶迅速增大,并出现新的转移灶,因此我们将该进展归类为放疗联合ICI治疗后的远端超进展。
此外,患者在接受RT联合ICI后短时间内出现了严重的血小板减少症。ICI 诱发的免疫性血小板减少症可能是一种严重且危及生命的不良事件,有时会导致不良临床结果。患有 3 级或更高级别ICI相关血小板减少症的患者的OS比无任何病因血小板减少症的患者更差(4.17 个月 vs. 13.31 个月)。治疗方案包括皮质类固醇、静脉注射免疫球蛋白、血小板生成素受体激动剂和利妥昔单抗。ICI诱发的血小板减少症的病理生理机制也不清楚。ICI治疗后CD4+和CD8+T细胞的重新活跃,以及炎症通路的激活,可能导致造血干细胞的自身免疫性破坏。在本文患者中,TPO迅速改善了化疗相关的血小板减少症,但在放疗联合卡瑞利珠单抗治疗后无法有效改善患者的病情。研究人员发现既往有报道称,在放疗前后使用ICI会导致致命的免疫性血小板减少症。值得注意的是,报道的患者在单一ICI治疗期间没有出现血液学irAE,但在颅内放疗后观察到血小板计数迅速下降。放疗会诱导肿瘤细胞凋亡和炎症,从而激活可介导血小板破坏的巨噬细胞。PD-1抗体可以结合PD-1并阻断PD-L1/PD-1和PD-L2/PD-1信号通路,后者与免疫耐受相关。一旦免疫耐受被破坏,单核吞噬细胞系统就会被激活,从而导致血小板破坏。在接受纳武利尤单抗治疗后出现超进展的胃癌患者的转移性淋巴结中检测到了显著的PD-L1阳性M2巨噬细胞浸润。研究人员在手术标本中检测到了巨噬细胞浸润,但由于在放疗联合卡瑞利珠单抗治疗后没有获取肿瘤组织,因此无法评估治疗后巨噬细胞浸润的变化。
此外,NGS证实JAK2拷贝数增加,IHC和IF显示手术标本中有JAK2蛋白表达。JAK2基因编码一种酪氨酸激酶,在JAK2/STAT3信号转导中起关键作用,而JAK2/STAT3信号转导主要参与调节巨核细胞的发育,从而促进血小板生成。除了JAK2拷贝数增加外,复发性血小板减少和TPO的应用可能会激活JAK2/STAT3信号通路作为反馈机制来刺激血小板生成。相反,JAK2基因扩增可能导致JAK2/STAT3通路持续激活,而该通路与多种人类癌细胞的存活、增殖、血管生成、抗凋亡、致癌和转移有关。此外,JAK2/STAT3通路的激活会降低T细胞活化、代谢活性和细胞周期进程,从而导致PD-L1介导的免疫逃逸,导致对ICI产生耐药性。也就是说,复发性血小板减少症和JAK2拷贝数增加提示预后不良。出于上述相同原因,研究人员无法检测到ICI和RT诱发的血小板减少症后JAK2/STAT3信号通路变异。
此外,该患者的TP53突变丰度为 57.93%。强效肿瘤抑制因子TP53的缺失可能与食管癌患者总体生存率较差有关。事实上,TP53与其它肿瘤相关基因具有调节相互作用。结直肠癌免疫组织化学分析显示,TP53错义突变(mutp53)与pJAK2和pSTAT3高水平活化之间存在相关性。在胰腺肿瘤中,p53功能缺失会激活JAK2-STAT3信号通路。总之,稳定的mutp53表达可激活JAK2/STAT3信号、驱动细胞周期进程并诱导增殖和侵袭。
本文报告了一名食管鳞状细胞癌患者,该患者在接受放疗和卡瑞利珠单抗治疗后立即出现严重血小板减少症,并经历了快速的远端超进展。ICI可能会引发异常的自身免疫反应,而放疗会加剧这种反应,导致一种促进巨噬细胞活化的疾病,从而导致血小板减少症。此外,JAK2拷贝数升高和JAK2/STAT3通路的异常激活(血小板减少症的负反馈通路)会导致血小板生物合成和免疫逃逸。TP53突变可能会激活JAK2/STAT3通路,从而导致肿瘤超进展。研究人员无法确认血小板减少症和超进展之间的直接相关性。需要进行前瞻性研究来证明血小板减少症后JAK2/STAT3通路变异的存在,并确定JAK2/STAT3通路是否可能导致超进展。未来的研究应在JAK2/STAT3激活和TP53突变患者与仅存在JAK2/STAT3激活的患者之间进行生存分析。
参考文献:
Wang H, Li Y, Qiu M, Wang J. Thrombocytopenia and hyperprogression after radiotherapy and camrelizumab treatment in an esophageal cancer patient with increased JAK2 gene copies: a case report. Front Oncol. 2024 Jun 21;14:1283428. doi: 10.3389/fonc.2024.1283428. PMID: 38974233; PMCID: PMC11224440.



