西安交通大学张明真/周琦团队Biomaterials:间变性甲状腺癌声动力/化疗联合治疗
时间:2024-09-03 18:00:43 热度:37.1℃ 作者:网络
甲状腺癌作为内分泌系统最常见的恶性肿瘤,近年来在全球范围内的发病率迅速上升。其中,间变性甲状腺癌是恶性程度最高的病理类型,患者常于初次检查时即诊断为肿瘤局部侵袭,甚至远处转移,导致该疾病的早期诊断和治疗困难。当前甲状腺癌的临床治疗方式主要包括手术,辅以放射性碘治疗和化疗。然而这些手段对间变性甲状腺癌患者的疗效有限,尤其是伴有邻近组织侵袭和转移者。目前间变性甲状腺癌患者的预后仍然很差,中位生存期为5个月,1年生存率仅为20%,同时该疾病的复发率高达30%。因此,开发一种新的治疗方法无疑是未来改善预后和延长间变性甲状腺癌患者无症状生存期的迫切需要。
超声作为临床常用的影像诊断工具,不仅可用于疾病的诊断,近年来在疾病治疗领域也发挥着积极作用。其中,声动力疗法(SDT)是近些年来快速发展起来的一种无创性抗癌治疗方法,结合了“声敏化”药物和非侵入性聚焦声学治疗能量,能够短时间内在肿瘤局部产生大量细胞活性氧,引起氧化应激,从而杀伤肿瘤细胞。声动力治疗具有组织穿透性强、聚焦性好、照射部位可选择且对周围正常组织损伤小等特征,与传统治疗手段相比展现出显著的优越性,在实体肿瘤治疗方面引起了广泛的关注。然而,由于肿瘤微环境缺氧和声敏剂在肿瘤部位富集差等问题,导致声动力疗法对于实体肿瘤的效果有限。
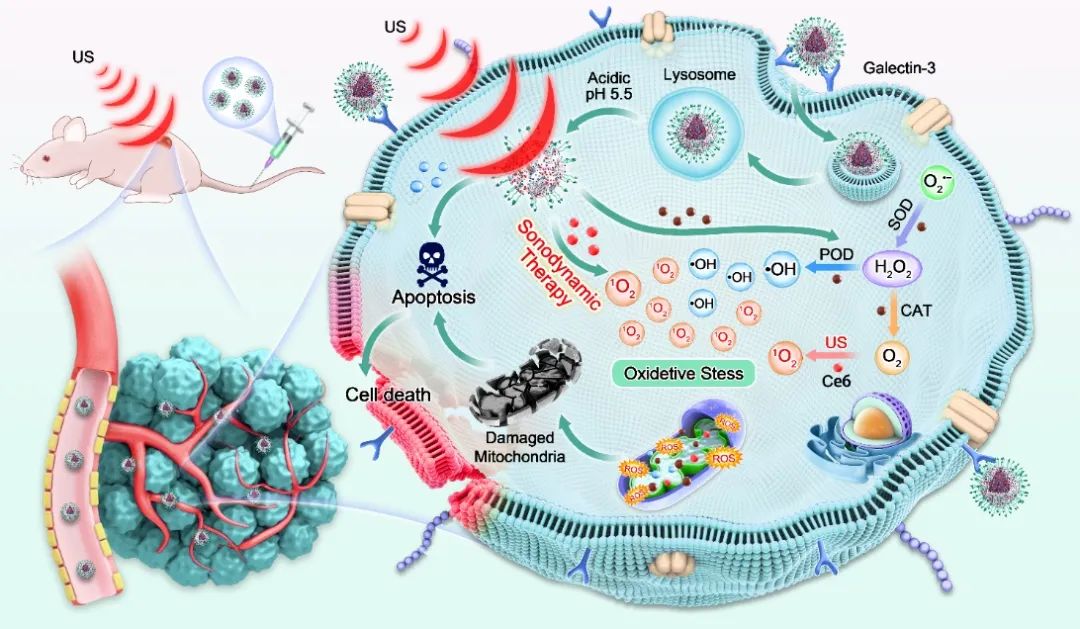
近期,西安交通大学张明真教授等人开发了一种pH响应仿生纳米载体(CLP@HP-A),实现了间变性甲状腺癌的化疗和声动力联合治疗。该研究通过以铂纳米酶镶嵌的有机框架Pt@ZIF-8为模板,表面修饰聚多巴胺的纳米载体,构建了同时负载乐伐替尼和声敏剂二氢卟啉e6的galectin-3靶向载药纳米复合体。体外细胞实验表明,CLP@HP-A能够特异性识别并有效杀伤甲状腺癌细胞。动物实验结果证明,CLP@HP-A不仅能够抑制甲状腺癌的生长,还能有效控制淋巴结和远处转移。转录组测序分析揭示了,CLP@HP-A主要是通过诱导细胞凋亡来杀伤肿瘤细胞的,支持了体外杀伤机制研究。相关工作以“A versatile nanoplatform carrying cascade Pt nanozymes remodeling tumor microenvironment for amplified sonodynamic/chemo therapy of thyroid cancer”为题发表在Biomaterials。

【文章要点】
在这项工作中,作者设计了一种基于金属有机框架(MOF)的智能仿生纳米载体,用于甲状腺癌症的协同化疗和SDT。如图1所示,CLP@HP-A纳米颗粒通过与肿瘤细胞表面的半乳凝素-3受体特异性结合进入细胞,实现药物靶向递送。接着经US照射,声敏剂Ce6被激活迅速产生大量活性氧(ROS),诱导细胞发生氧化应激并进一步引发凋亡。在此过程中,Pt纳米酶催化H2O2转化为O2,缓解了肿瘤微环境缺氧,同时产生羟基自由基(•OH)提高细胞内ROS水平,增强了声动力疗效。此外,Len通过诱导细胞凋亡对甲状腺癌细胞具有强大的杀伤作用。
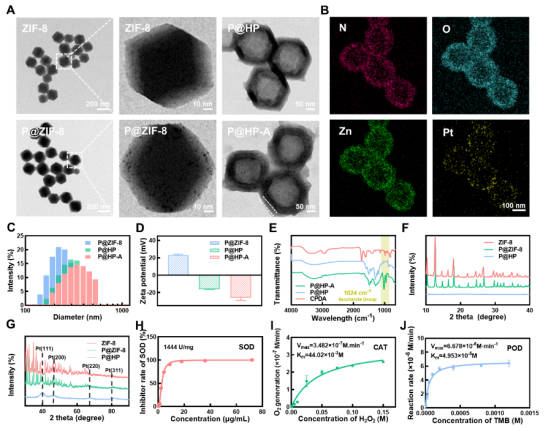
在这项工作中,作者首先合成了具有中空多面体结构的纳米载体,在此基础上进行了药物负载。多种检测方式都证明了材料的成功合成。同时体外非细胞实验结果表明,该仿生智能纳米平台拥有良好的SOD酶活、CAT酶活和POD酶活,能够有效分解内源性H2O2转化为O2或生成•OH,同时通过超声照射进一步催化O2生成1O2,共同促进ROS产生。
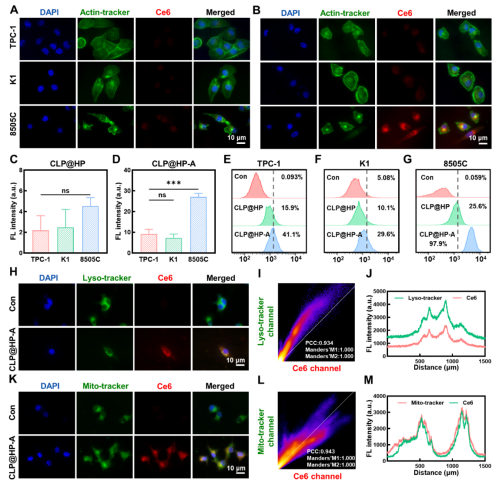
在本研究中,甲状腺癌细胞对CLP@HP-A的摄取能力与其Gal-3的表达量呈正相关,且具有时间依赖性。随着孵育时间的增加,细胞摄取量在孵育4小时后达到峰值,然后开始逐渐减少。所以作者以最佳摄取时间4小时作为超声照射的时间点,指导后续的体内外治疗。线粒体是ROS产生和工作的主要场所,在ROS介导的细胞毒性中起着重要作用。研究结果表明,CLP@HP-A通过受体介导的内吞作用进入细胞后,首先分布于溶酶体中,部分被递送到线粒体。此时,声敏剂经超声波照射可以超声产生大量的ROS。细胞内过量的ROS会引起氧化应激,从而导致脂质过氧化、蛋白质损伤和DNA断裂,从而杀伤肿瘤细胞,最终实现肿瘤治疗的目的。
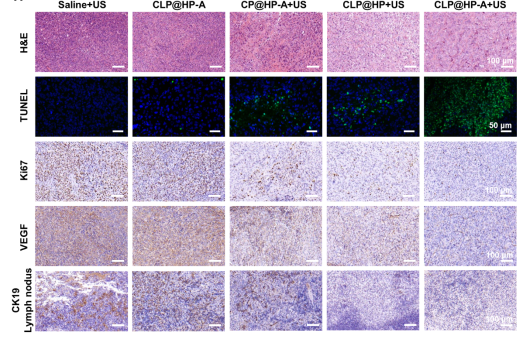
体内研究结果表明,该仿生智能纳米平台能够显著抑制甲状腺肿瘤的生长,同时治疗小鼠的体重、血液学指标和重要脏器等均未见明显异常。免疫组化结果显示,对照组小鼠在治疗结束后出现了明显的淋巴结和肝脏转移,而治疗组小鼠未发现,同时治疗组的肿瘤组织细胞凋亡明显,增殖速率降低,抑制肿瘤组织血管增殖和淋巴结组织转移指标均显著较对照组低。上述结果证明,这项工作设计的仿生纳米平台具有良好生物安全性,同时能够有效抑制甲状腺癌的生长以及其淋巴结和远处转移。
【结论与展望】
CLP@HP-A纳米颗粒在体内外都表现出了出色的靶向摄取能力和生物相容性,同时能够通过缓解肿瘤组织缺氧和增加ROS产生,增强了SDT疗效和协同抗肿瘤疗效。总之,仿生纳米载体为甲状腺癌的联合治疗提供了一种新的策略,在恶性肿瘤治疗领域具有发展前景。
原文链接:


