毛海泉教授,最新Nature Chemical Engineering:调节细胞外液粘度可提高转染效率
时间:2024-09-18 06:02:02 热度:37.1℃ 作者:网络
基因疗法
由病毒或非病毒载体介导的基因治疗已成为治疗先天性和获得性疾病的有效方法,此外其也可以用于开发预防性和治疗性疫苗。其中许多疗法涉及使用脂质纳米颗粒(LNPs)和多聚体纳米颗粒等非病毒载体以及慢病毒载体(LVVs)和腺相关病毒(AAVs)等载体,以对细胞系或患者来源的细胞进行体外基因修饰。此外,病毒载体的生产主要依赖于生产细胞系(如HEK293细胞)中的有效转染技术。而这些疗法的高成本中有很大一部分与细胞转染过程有关,因此这为进一步优化治疗留下了很大的空间。
细胞培养条件在其迁移和内吞等生理过程中起着重要作用。细胞对一系列生物物理刺激有反应,包括环境因素,如硬度、流体剪切应力、液压和细胞外液粘度。最近的研究强调,细胞外液粘度是一种物理线索,可通过增强肌动蛋白聚合和Na+/H+交换子(NHE)的激活,在体外和体内增强运动、细胞解离和外渗。NHE介导的水流入可以产生细胞边界运动,是细胞表面生物力学的关键因素。这些过程也与各种形式的内吞内化有关,包括吞噬作用、大吞噬作用、网格蛋白介导的内吞作用和小窝介导的外吞作用;而后者恰恰是参与细胞转染的主要途径。到目前为止,大多数体外细胞转染方法都是使用37°C下流体粘度为0.8厘泊(cP)的细胞培养基进行的,远低于人体细胞外液(4.0-8.0 cP),如间质液和血液。
提高转染效率
基因治疗和细胞编程依赖于有效的细胞转染。尽管载体开发和转染技术不断进步以提高效率,但细胞外液粘度等生物物理参数的影响在很大程度上被忽视了。在这项研究中,约翰霍普金斯大学毛海泉教授和Sean X. Sun等人报告了培养基粘度对递送载体转染效率的重大影响,包括脂质纳米颗粒、复合物、腺相关载体和慢病毒载体在各种细胞类型中的转染效率。研究观察到,当培养基粘度与生物流体的粘度相匹配时(2.0-4.0厘泊(cP)),脂质纳米颗粒和复合物的转染效率显著提高。研究发现,这种增强与更高水平的细胞摄取和改善的内体逃逸有关。此外,在优化的粘度条件下培养的细胞与在0.8 cP的标准粘度下培养的那些细胞相比,表现出不同的摄取途径。这一发现突显了培养基粘度在转染过程中的关键作用,并提供了一种优化基因递送和细胞编程过程的额外方法,有望降低生产成本,增加基因和细胞疗法的可及性。相关工作以“Tuning extracellular fluid viscosity to enhance transfection efficiency”为题发表在Nature Chemical Engineering。

【文章要点】
在这项研究中,作者发现细胞外液粘度是一个有效的生物物理参数,对非病毒纳米颗粒和病毒载体的细胞转染效率有重大影响。通过引入具有特定粘度的细胞外液,可以提高转染效率,在不同细胞类型中可以提高几倍到几百倍。在这项研究中,作者重点研究了典型细胞转染过程中涉及的几个主要通用因素,如遗传有效载荷的类型和递送载体的类型。就LNP或多聚体纳米颗粒递送的遗传货物类型而言,尽管mRNA通常比pDNA介导更高的转染效率,但增加培养基粘度的增强作用适用于这两种类型的治疗有效载荷。就递送载体的类型而言,在介质粘度升高的情况下,这些不同类型的递送载体(包括LNP、多聚体纳米颗粒和病毒颗粒)的增强效果是一致的。这些发现表明,应用培养基粘度来提高转染效率可以作为一种普遍的方法,与转染载体和基因货物的类型无关。特别是,在B16-F10细胞中,将mRNA LNP的剂量加倍会导致转染率增加1.78倍(P<0.01),而在相同的LNP剂量下,将培养基粘度加倍至2.0 cP会导致转染效率增加12.60倍(P<0.0001),这表明与增加LNP剂量相比,培养基粘度对转染效率的影响要大得多(图1)。
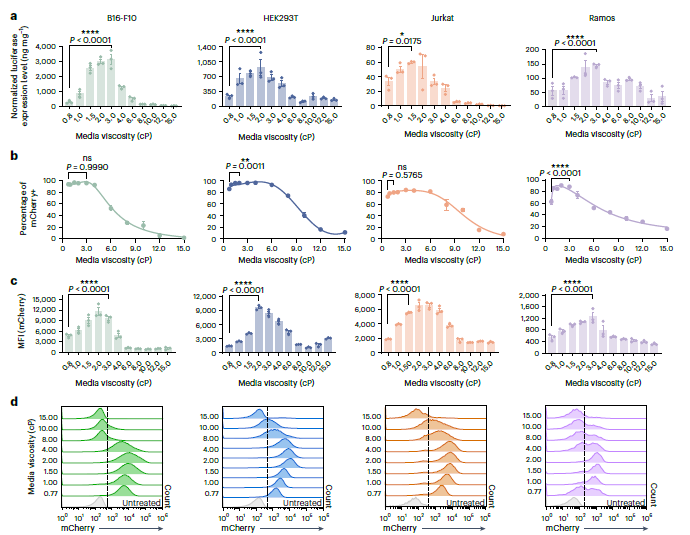
图1 mRNA LNPs介导的细胞外液黏度依赖性转染效率
尽管细胞外粘度升高通常会导致大多数毒性不明显的细胞类型的转染效率更高,但值得注意的是,优化的培养基粘度因不同细胞类型而异。这种变化可能是由于转染过程中不同细胞之间的细胞张力、收缩性和肿胀动力学及其生理条件的差异造成的。更有趣的是,研究观察到,超过一定的粘度阈值(>8.0 cP)会导致LNP和多聚体纳米颗粒的转染效率下降,而病毒颗粒没有观察到这种下降。作者认为这种差异源于病毒和非病毒颗粒之间转染过程的固有差异。在非病毒颗粒的情况下,转染效率的降低可能是由于纳米颗粒的扩散速率较低,导致纳米颗粒与细胞之间的接触机会减少。或者,在超生理流体粘度(>8.0 cP)下,细胞内运输过程可能会发生负面变化,因此对转基因表达不利。未来的研究需要更全面的调查和分析来验证和完善这些假设(图2)。
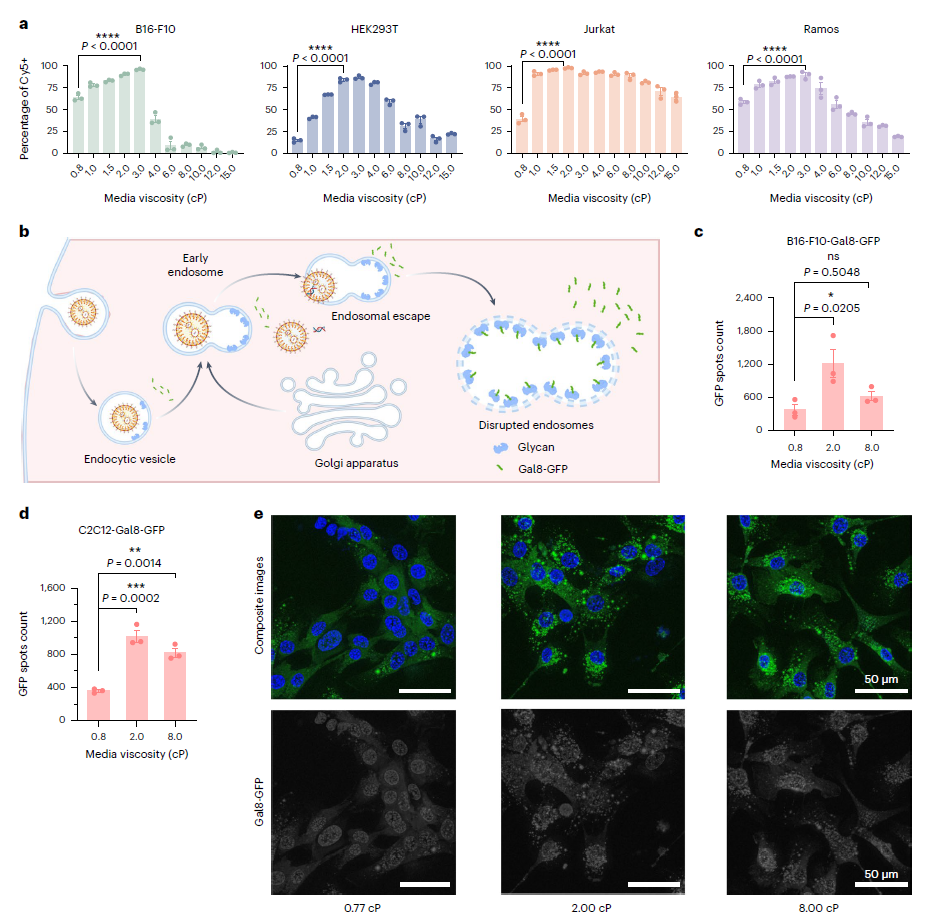
图2 培养基粘度对mRNA LNPs细胞摄取和内体逃逸效率的影响
这种介质粘度诱导的增强效应与使用mRNA LNPs作为模型载体的细胞摄取和内体逃逸密切相关。通过使用各种抑制剂,机制研究揭示了培养基粘度与mRNA LNPs细胞摄取途径之间的明显相关性。在B16-F10细胞的最佳粘度(2.0 cP)下,与标准粘度培养基条件下相比,LNP摄取的主要途径转向网格蛋白介导的内吞作用和大单胞作用。该研究强调了LNP转染中介导粘度诱导的增强效应与细胞皮质张力、收缩性和肿胀动力学之间的直接相关性,证实了粘度升高会刺激ARP2/3复合物依赖的肌动蛋白网络重塑,增加NHE1极化和膜张力,从而共同增强LNP的摄取并促进内体逃逸。肌动蛋白动力学、NHE1介导的膜变化和RhoA驱动的收缩性的整合巩固了细胞对环境粘度的复杂反应(图3)。
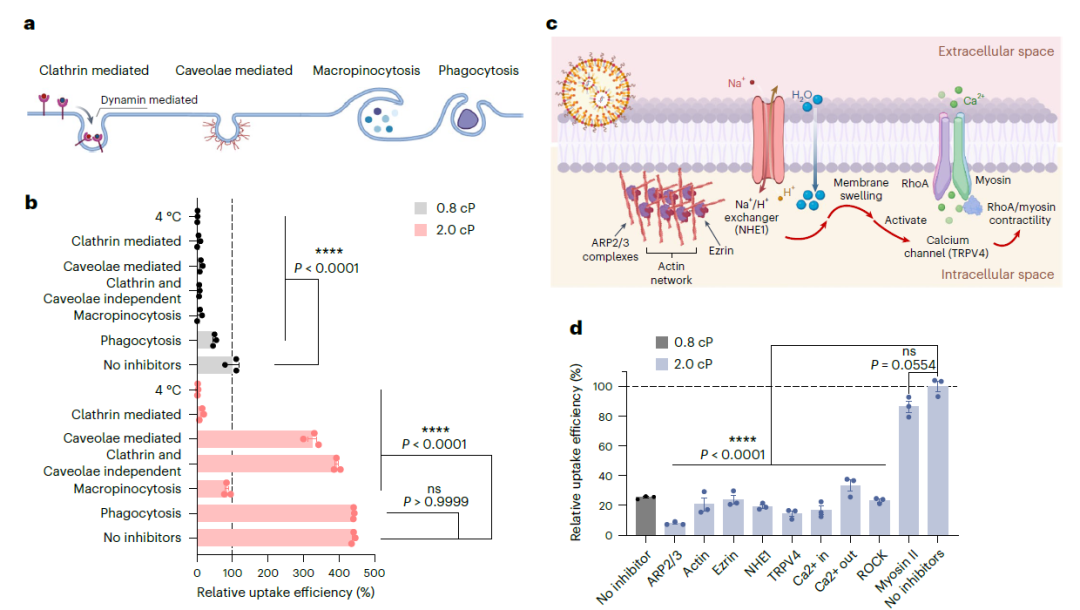
图3 细胞摄取途径和肌动蛋白重塑/动力学,NHE1介导的肿胀和基于RhoA的收缩在不同黏度对mRNA LNPs的内吞作用
【结论与展望】
这些发现强调了细胞摄取机制和外部物理条件之间的复杂相互作用,为优化基于纳米粒子的基因递送系统和过程提供了宝贵的见解。除了摄取和内体逃逸过程外,其他细胞过程,如蛋白质合成,也可能受到影响,并有助于整体改善转基因表达结果。因此,在未来需要更多的研究来充分了解各种细胞生理过程在整体细胞转染结果中的作用。
原文链接:
https://doi.org/10.1038/s44286-024-00116-3


