李高峰教授组稿|罗详冲:深入探讨晚期 EGFR 敏感突变非小细胞患者一线治疗新策略
时间:2024-10-12 17:01:15 热度:37.1℃ 作者:网络
编者按:EGFR突变作为非小细胞肺癌最常见驱动基因,其在整个亚洲晚期肺腺癌人群中的突变率高达40-60%[1]。编码EGFR的基因位于18号-24号外显子,而非小细胞肺癌EGFR突变主要发生在18号-21号外显子,其中19号外显子缺失突变和21号外显子L858R点突变约占所有EGFR突变的90%,被称为EGFR敏感突变或EGFR经典突变,而G719X突变(G719A/G719S/G719C)、E709X突变、19号外显子插入突变、20号外显子插入突变、T790M点突变、S768I点突变、L861Q点突变等类型因突变率低,被称为EGFR罕见突变或EGFR不常见突变[2]。
随着EGFR-TKIs一代(吉非替尼、埃克替尼、厄洛替尼)、二代(阿法替尼、达克替尼)、三代(奥希替尼、阿美替尼、伏美替尼、贝福替尼)的更新迭代,彻底改变了EGFR突变非小细胞肺癌治疗格局,掀起了21世纪肿瘤治疗领域最伟大的浪潮。随后FLAURA研究、AENEAS研究和FURLONG研究的成功,奥希替尼、阿美替尼和伏美替尼单药治疗显著提高了晚期EGFR经典突变肺癌患者的PFS和OS。与此同时,EGFR-TKIs耐药问题仍然是目前面临的最大难题和挑战,如何延缓或克服耐药成为探索热点,联合治疗模式应运而生,FLAURA2研究开启了全球首个探讨三代EGFR-TKI联合化疗一线治疗晚期EGFR敏感突变非小细胞肺癌的先河,并取得了惊艳的数据。基于FLAURA2研究的成功,本文将对晚期EGFR敏感突变非小细胞肺癌一线治疗策略进行最新的梳理和深入探讨,以期为临床提供参考。
本期「专家组稿」由北京大学肿瘤医院云南医院李高峰教授担任执行主编,与曲靖市第二人民医院心胸外科罗详冲医生共同分享《深入探讨晚期EGFR敏感突变非小细胞患者一线治疗新策略》,为医者和患者提供更多参考。
EGFR敏感突变亚组细分人群的治疗策略
既往指南推荐及临床应用中,都将EGFR-TKIs单药作为EGFR敏感突变晚期非小细胞肺癌的一线标准治疗方案,从一代到二代再到三代的更迭,单药靶向治疗遇到了瓶颈和壁垒。随着FLAURA2研究的成功[3],奥希替尼联合化疗组和奥希替尼单药组的中位PFS分别为25.5个月和16.7个月,而由BICR评估的两组的中位PFS分别为29.4个月和19.9个月,由此奠定了靶向联合化疗的地位,成为一线治疗新策略,也标志着靶向联合化疗时代的到来,一线治疗的排兵布阵也需重新进行考量。
FLAURA2研究对EGFR敏感突变亚组人群进行细分,发现19外显子缺失突变和21外显子L858R突变的两组人群对EGFR-TKIs的疗效存在差异,在19外显子缺失突变的患者中,奥西替尼联合化疗组的中位PFS为27.9个月,而奥西替尼单药组为19.4个月;在21外显子L858R突变亚组人群中,奥西替尼联合化疗组的中位为24.7个月,而奥西替尼单药组为13.9个月,两个亚组人群均有明显获益,但21外显子L858R亚组靶向联合化疗较靶向单药的中位PFS提升近11个月,获益更加明显。而且既往已经证实,与19外显子缺失突变患者相比,21外显子L858R突变患者接受EGFR-TKIs治疗的临床获益差。
因此,19外显子缺失突变和21外显子L858R突变两组人群中治疗方案的选择需重新权衡(表一),两组人群均可一线优先靶向联合化疗,但与19外显子缺失突变组相比,遇到21外显子L858R突变的人群更应优选靶向联合化疗,而不是单药靶向治疗。
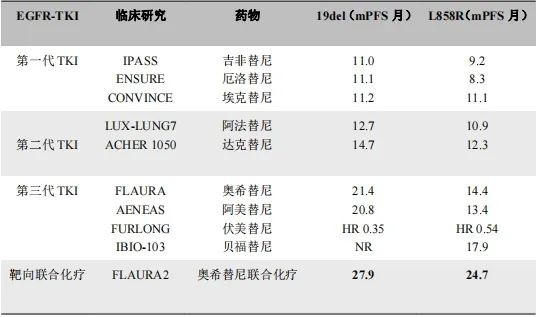
表一 各种EGFR-TKIs治疗19del和L858R突变的数据对比
EGFR敏感突变合并脑转移人群的治疗策略
EGFR突变阳性肺癌患者脑转移发生率高,由于靶向药物的耐药性,大分子药物包括化疗、PD-1/PD-L1抑制剂及抗血管生成药物等很难穿透血脑屏障,导致肺癌脑转移治疗的不理想,真实临床实践中,仍需不断探索,努力改善肺癌脑转移患者的生活质量和延长OS。从FLAURA研究和AENEAS研究到FLAURA2研究的不断探究,目的都是为通过联合治疗延缓或克服耐药带来的治疗瓶颈。
FLAURA2研究公布的EGFR敏感突变合并脑转移亚组人群的结果显示(图一),奥希替尼联合化疗组在脑转移BICR全分析集(cFAS,具有≥1个可测量病灶和/或非可测量病灶的患者)和脑转移可评估疗效集(cEFR,具有≥1个可测量病灶的患者)中的ORR分别为73%和88%,ORR数据都非常惊艳。在cEFR中,奥希替尼联合化疗组脑转移的CR比例高达48%,意味着近50%的患者接受靶向联合化疗后颅内病灶完全消失,对比奥希替尼单药组的CR比例16%,奥希替尼联合化疗的获益非常明显,为靶向单药治疗的3倍。
基于以上数据,不难看出,EGFR敏感突变合并脑转移亚组人群的一线治疗不再局限于单药靶向治疗,更优选择为靶向联合化疗,同时研究表明,靶向联合化疗与单药靶向治疗的耐药机制相似,并不影响后线治疗的选择,且安全性可耐受。
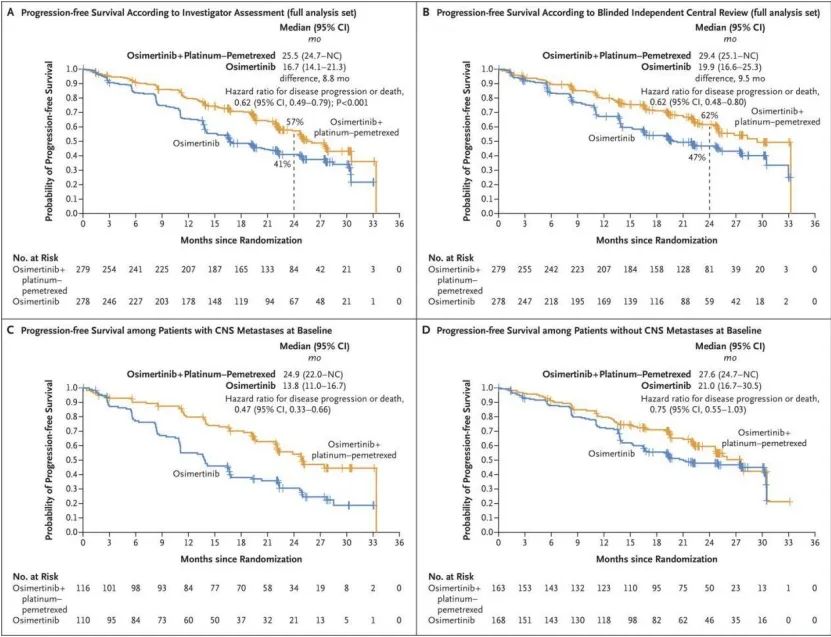
图一(A+B)图表示奥希替尼联合化疗对比单药奥希替尼的整体PFS;(C+D)图表示奥希替尼联合化疗对比单药奥希替尼在EGFR敏感突变合并脑转移亚组人群中的PFS
EGFR敏感复合突变人群的治疗策略
EGFR敏感突变19外显子缺失和21外显子L858R点突变约占EGFR全部突变的85%[4]。此外,EGFR突变还包括G719X、S768I、L861Q、复合突变以及20外显子插入突变等15%左右的罕见类型[5](图二)。目前针对EGFR罕见突变的一线治疗为阿法替尼,其次可选择药物如奥希替尼、阿美替尼、伏美替尼及一代靶向药物等。
但在真实临床实践中,常常会遇到EGFR复合突变的情况。EGFR复合突变是指在酪氨酸激酶结构域上同时存在两种及以上不同类型的EGFR突变位点。复合突变类型主要包括敏感突变复合敏感突变(L858R+19del)、敏感突变(L858R和/或19del)复合罕见突变(如G719X、S768I和L861Q等)、罕见突变复合罕见突变(两种及以上罕见突变)以及原发T790M突变复合任何EGFR突变类型[6]。EGFR复合突变的发生率占EGFR突变例数的4%-26%左右。不同复合突变类型发生率不一致(图三),对EGFR-TKIs敏感性也不同,治疗疗效也各存在差异[7](图四)。
目前由于敏感型复合敏感型突变概率低,样本量少,在FLAURA2研究中也只纳入了3例L858R+19del复合敏感突变的病例,靶向联合化疗均取得更优的PFS,因此,针对EGFR敏感型复合敏感型突变患者,靶向联合化疗似乎是更优选择,但还需更大样本证实。但对于EGFR敏感型复合罕见型的患者,目前尚未有大样本前瞻性临床研究证实靶向联合化疗较单药靶向治疗更优,是否可将FLAURA2研究进行延伸,尚不得而知,期待将EGFR敏感复合突变类型的研究进行更深入的探索,细化每种类型的最佳治疗方案。
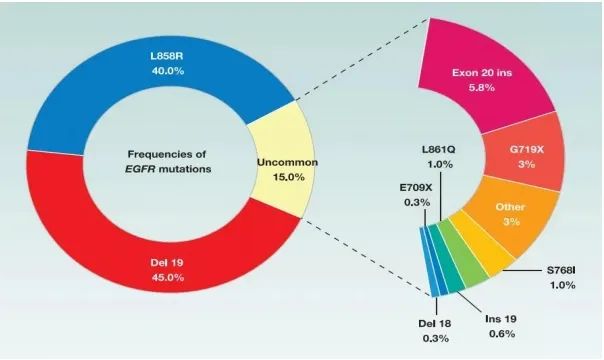
图二 EGFR各类型突变概率
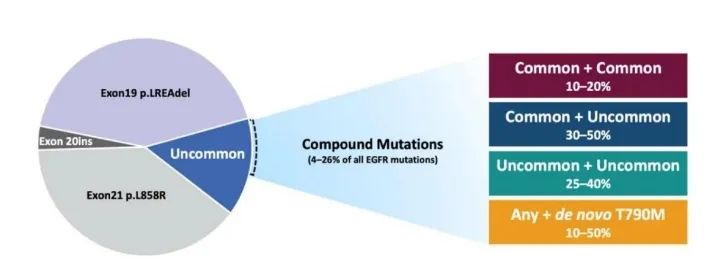
图三 不同复合突变发生概率
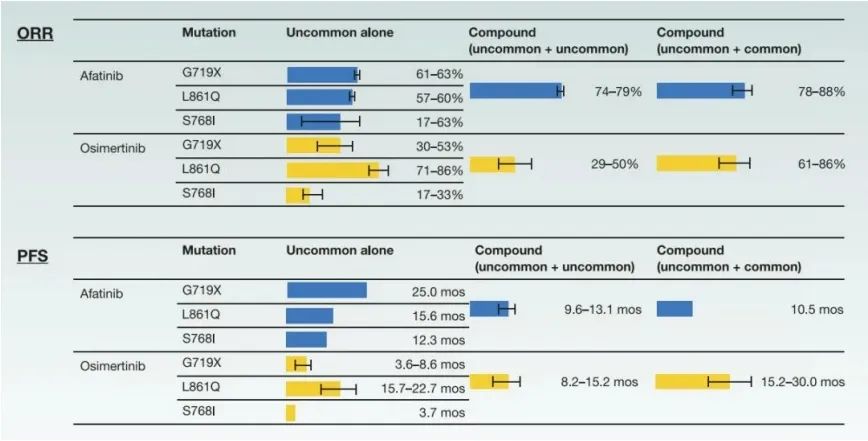
图四 阿法替尼和奥希替尼治疗复合突变的ORR和PFS
EGFR敏感共突变人群的治疗策略
随着基因检测技术如NGS测序的提高,EGFR与其他基因如TP53、PIK3CA、ALK、KRAS、MET扩增、PTEN等共同突变的患者越来越多被检出[8]。针对共突变人群的治疗仍没有统一的专家共识及指南推荐,制约着真实临床实践中治疗方案的制定。目前针对EGFR敏感共突变人群,临床选择普遍为单药靶向治疗,这种方案往往容易发生耐药而导致患者OS和PFS的缩短。因此,单一的靶向治疗并不能满足于临床,共突变人群治疗的探索任重道远。
既往多项临床研究如JO25567、NEJ026、ARTEMIS、ACTIVE、RELAY、ALTER-L004、FLAURA2等[9-11]已表明,联合治疗如靶向联合化疗、双靶治疗及靶向联合抗血管生成三大策略在EGFR敏感共突变人群中取得不错的结果,部分联合治疗方案优于单靶治疗,明显延长了患者的OS与PFS。
值得注意的是,最新的首个前瞻性CTONG2008(FLOWERS)临床研究[12]证实了奥希替尼联合赛沃替尼的双靶策略治疗EGFR突变合并原发MET扩增的晚期非小细胞肺癌患者优于奥希替尼单靶治疗,奥希替尼联合组的ORR为90.5%,DCR为95.2%,中位DoR为18.6个月,中位PFS为19.6个月;奥希替尼单药组的ORR为60.9%,DCR为87%,中位DoR为8.4个月,中位PFS为9.3个月(图五),可以看出ORR和PFS的明显获益。
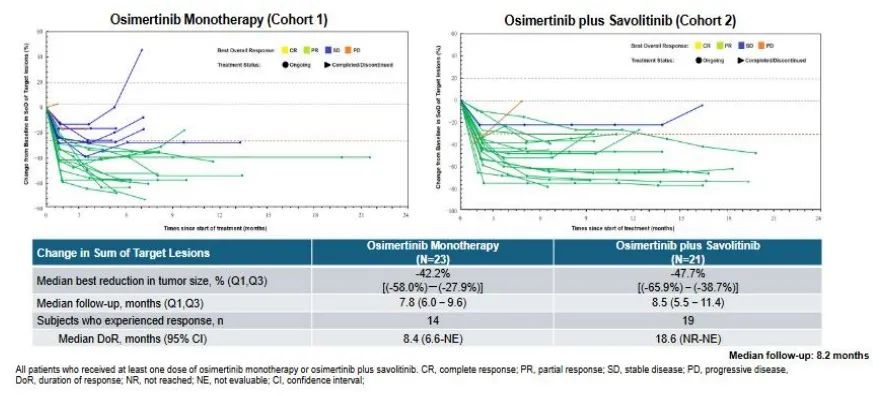
图五 奥希替尼联合赛沃替尼与奥希替尼单药治疗的比较
目前联合治疗策略百花齐放,然而,EGFR-TKIs联合化疗、EGFR-TKIs联合抗血管生成药物、双靶治疗何为最佳治疗方案仍缺乏头对头比较。因此,大样本、前瞻性、多维度横向及纵向的临床研究仍是EGFR敏感共突变人群未来探索的目标,个体化、精准化的联合治疗模式需更多询证医学证据的支持。
总结
综上所述,从EGFR敏感突变亚组细分人群、合并脑转移人群到复合突变人群和共突变人群治疗策略的探索中,可以看出优化联合治疗模式如EGFR-TKIs联合化疗、EGFR-TKIs联合化疗和双靶治疗是目前乃至未来的方向和热点。FLAURA2和FLOWERS研究为靶向联合化疗和双靶治疗提供了强有力的询证医学证据,重塑了晚期EGFR敏感突变非小细胞肺癌患者一线治疗新选择。但在真实临床实践中,需要综合评估每个患者的全身状况如EGFR突变细分情况,基线如合并脑转移情况,ECOG评分以及安全性等选择个体化和精准化的治疗方案。学会如何从单靶思路转向至联合模式,如何从单一维度迈向多维度的探索,需扩展思路,打破治疗壁垒,精准克服耐药,解决临床需求,助力患者获益。
参考文献
[1] Shen J, Chen L, Liu J, et al. EGFR degraders in non-small-cell lung cancer: Breakthrough andunresolved issue. Chem Biol Drug Des. 2024 Apr;103(4):e14517. doi: 10.1111/cbdd.14517. PMID:
38610074.
[2] Borgeaud M, Parikh K, Banna GL, et al. Unveiling the Landscape of Uncommon EGFR Mutations in NSCLC-A Systematic Review. J Thorac Oncol. 2024 Jul;19(7):973-983. doi:
10.1016/j.jtho.2024.03.016. Epub 2024 Mar 16. PMID: 38499147.
[3] Planchard D, Jänne PA, Cheng Y, et al. Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med. 2023 Nov 23;389(21):1935-1948. doi:
10.1056/NEJMoa2306434. Epub 2023 Nov 8. PMID: 37937763.
[4] Shaban N, Kamashev D, Emelianova A, et al. Targeted Inhibitors of EGFR: Structure, Biology,
Biomarkers, and Clinical Applications. Cells. 2023 Dec 25;13(1):47. doi: 10.3390/cells13010047.
PMID: 38201251; PMCID: PMC10778338.
[5] Borgeaud M, Parikh K, Banna GL, et al. Unveiling the Landscape of Uncommon EGFR
Mutations in NSCLC-A Systematic Review. J Thorac Oncol. 2024 Jul;19(7):973-983. doi:
10.1016/j.jtho.2024.03.016. Epub 2024 Mar 16. PMID: 38499147.
[6] Seker-Cin H, Tay TKY, Kazdal D, et al. Analysis of rare fusions in NSCLC: Genomic
architecture and clinical implications. Lung Cancer. 2023 Oct;184:107317. doi:
10.1016/j.lungcan.2023.107317. Epub 2023 Jul 27. PMID: 37586177.
[7] Fukuda A, Okuma Y. From Rarity to Reality: Osimertinib's Promising Horizon in Treating
Uncommon EGFR Mutations in Non-Small Cell Lung Cancer. Clin Cancer Res. 2024 Aug
1;30(15):3128-3136. doi: 10.1158/1078-0432.CCR-23-4035. PMID: 38767589.
[8] Guo Y, Song J, Wang Y, et al. Concurrent Genetic Alterations and Other Biomarkers Predict
Treatment Efficacy of EGFR-TKIs in EGFR-Mutant Non-Small Cell Lung Cancer: A Review.
Front Oncol. 2020 Dec 10;10:610923. doi: 10.3389/fonc.2020.610923. PMID: 33363040; PMCID:
PMC7758444.
[9] Zhang L ZH, Zhang Z, Yao W, et al. ACTIVE: Apatinib plus gefitinib versus placebo plus
gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant (EGFRm)
non-small-cell lung cancer (NSCLC): A multicentered, randomized, double-blind,
placebo-controlled phase III trial (CTONG1706)[J]. Ann Oncol (2020) 31(suppl_4):S1142–215.
[10] Nishio M, Paz-Ares L, Reck M, et al. RELAY, Ramucirumab Plus Erlotinib (RAM+ERL) in
Untreated Metastatic EGFR-Mutant NSCLC (EGFR+ NSCLC): Association Between TP53 Statusand Clinical Outcome[J]. Clin Lung Cancer. 2023 Jul;24(5):415-428.
[11] Zhang L, Wang L, Wang J, et al . Anlotinib plus icotinib as a potential treatment option for
EGFR-mutated advanced non-squamous non-small cell lung cancer with concurrent mutations:
final analysis of the prospective phase 2, multicenter ALTER-L004 study[J]. Mol Cancer. 2023 Aug 5;22(1):124.
[12] J Yang,et al.Osimertinib With or Without Savolitinib as 1L in De Novo MET Aberrant,
EGFRm Advanced NSCLC(CTONG 2008):A Phase II Trial.2024 WCLC,PL04.10.


