Small:武汉大学黎威/胡汉昆提出一种用于持续治疗特应性皮炎的多功能双层微针(MN)贴片
时间:2024-11-21 17:02:12 热度:37.1℃ 作者:网络
特应性皮炎(AD)是一种复杂且普遍的慢性炎症皮肤病,影响着全球很大一部分人口。传统治疗往往靶向单一致病因素,或受到皮肤渗透的限制,难以满足治疗需求。
2024年11月15日,武汉大学黎威、胡汉昆共同通讯在 Small 在线发表题为“Double-Layered Microneedle Patch Integrated with Multifunctional Nanoparticles and Live Bacteria for Long-Term Treatment of Atopic Dermatitis”的研究论文。该研究提出了一种多功能双层微针(MN)贴片,通过整合治疗性纳米颗粒(NPs)和活细菌,达到持续治疗AD的目的。
MN尖端负载封装盐酸西替利嗪(CET@PB NP)的普鲁士蓝NP,基底则含有枯草芽孢杆菌(B.subtilis)。插入皮肤后,MN贴剂将CET@PB NP递送到皮肤中,快速溶解将活枯草芽孢杆菌沉积在皮肤表面。递送的NPs不仅可以清除活性氧(ROS)并改善AD病灶中的氧化应激微环境,还可以在皮肤中持续释放抗组胺药CET,以缓解AD症状。此外,枯草芽孢杆菌在皮肤上存活超过9天,有效抑制金黄色葡萄球菌的生长。该研究表明MN贴剂能够长期、有效治疗AD,为临床皮肤病治疗提供了一种替代方案。

特应性皮炎(AD)是一种普遍存在的慢性皮肤病,其特征是皮肤干燥、炎症浸润、频繁复发和剧烈瘙痒,严重影响患者的日常活动和生活质量。据估计,全球AD的终生患病率高达20%,构成了重大的公共卫生威胁。作为一种自身免疫性疾病,AD的病因尤为复杂,涉及2型T辅助细胞(Th2)相关的免疫失调、皮肤屏障功能受损、微生物失衡与金黄色葡萄球菌(S.aureus)定植、活性氧(ROS)水平升高,加剧了AD病变。
AD的传统治疗方法包括全身免疫抑制剂和抗组胺药,虽然表现出一定治疗效果,但通常需要重复给药,导致免疫功能障碍、皮肤萎缩和高血糖等严重副作用。一般来说,局部给药可有效靶向病变部位,从而避免全身性副作用。如局部皮质类固醇给药是减轻AD患者炎症的常用方法。此外,研究人员还开发了多种用于AD治疗的创新性透皮给药系统,如水凝胶、乳膏和基于纳米颗粒(NPs)的局部制剂。然而,最外层的皮肤层,即角质层,在AD皮肤中特别厚,限制了药物通过皮肤的渗透和吸收,从而使治疗效果大打折扣。此外,局部皮质类固醇或其他透皮制剂通常需要每天施用一到两次或每周施用多次,显著降低了患者的依从性。AD复杂的病因通常会限制单因素治疗效果,,金黄色葡萄球菌经常定居于AD病灶,分泌超抗原,引发Th2细胞相关的免疫失调和皮肤炎症,进一步加重表皮屏障损伤。因此,使用传统局部制剂或仅靶向AD的单一致病因素产生的治疗效果往往有限。
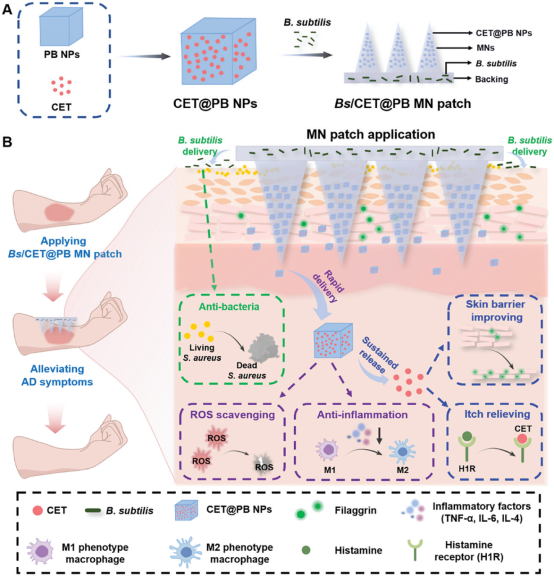
图1 用于AD治疗的Bs/CET@PB MN贴剂示意图(摘自Small )
微针(MNs)是一种新型透皮给药方法,可以微创穿透角质层,直接将药物输送到表皮或浅表真皮层,显著提高透皮给药效率。因此,MN在生物医学领域中的应用得到了广泛研究,包括皮肤癌、伤口愈合、毛发再生、糖尿病和避孕,具有快速释药或持续释药特性。利用其穿透增厚的表皮层并将药物有效地输送到深层病灶的能力,基于MN的AD治疗研究不断发展。然而,仍缺乏可以从多个方面改善AD症状的MN贴片。
该研究开发了一种用于AD治疗的新型多功能双层MN贴剂。MN贴片由水溶性基质制成,有助于有效载荷的溶解和快速释放。针尖层封装了载有盐酸西替利嗪的普鲁士蓝NP(CET@PB NPs),而基底层则包含枯草芽孢杆菌(B.subtilis,Bs)活细菌。皮肤插入后,MNs迅速溶解,在皮肤中释放出CET@PB NPs,显示出清除ROS的多种酶活性,改善了AD病灶中的氧化应激微环境,并降低了促炎细胞因子水平,如肿瘤坏死因子α(TNF-α)和白细胞介素-6(IL-6)。此外,NPs在皮肤中持续释放CET,通过上调聚丝蛋白(FLG)和loricrin(LOR)的表达来缓解瘙痒并改善皮肤屏障。值得注意的是,基底层溶解后枯草芽孢杆菌的活细菌被输送到皮肤表面,在皮肤上存活超过9天,竞争性地抑制了定植在病变表面的金黄色葡萄球菌,改善了皮肤上的微生物失衡。因此,由于具有清除ROS、改善皮肤屏障、缓解瘙痒和纠正微生物失衡的独特特性,双层多功能MN贴剂在体内长期治疗AD方面表现出卓越疗效,为临床皮肤病治疗提供了新途径。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202409121


