Glofitamab联合GemOx与利妥昔单抗联合GemOx治疗R/R DLBC 的比较:一项全球性3期、随机、开放标签试验
时间:2024-11-24 12:00:51 热度:37.1℃ 作者:网络
研究背景
Glofitamab(格非妥单抗)单药治疗在接受过两种或以上前期治疗的复发或难治性弥漫大B细胞淋巴瘤患者中显示出良好疗效,但尚未作为二线治疗进行评估。
本研究旨在调查Glofitamab联合吉西他滨-奥沙利铂(Glofit-GemOx)与利妥昔单抗联合吉西他滨-奥沙利铂(R-GemOx)在复发或难治性弥漫大B细胞淋巴瘤患者中的疗效和安全性。
研究方法
STARGLO是一项全球、随机、开放标签3期临床研究 (NCT04408638)。
入组标准:患者年龄≥18岁;ECOG评分0-2分;组织学确诊的复发或难治性弥漫性大B细胞淋巴瘤,非特指型;既往接受过一种或多种全身性治疗;不符合ASCT标准。
患者按2:1的比例随机分配至Glofit-GemOx组(静脉注射吉西他滨1000 mg/m²和奥沙利铂100 mg/m²,联合逐步增加剂量至30 mg的Glofitamab,总计8个周期,随后单用Glofitamab再治疗4个周期)或R-GemOx组(静脉注射吉西他滨1000 mg/m²和奥沙利铂100 mg/m²,联合利妥昔单抗375 mg/m²,总计8个周期)。
分层因素包括前期治疗线数(1 vs. ≥2)以及复发与难治性状态。
主要终点:总生存期(OS)
次要终点:无进展生存期(PFS)、完全缓解率和完全缓解持续时间
研究结果
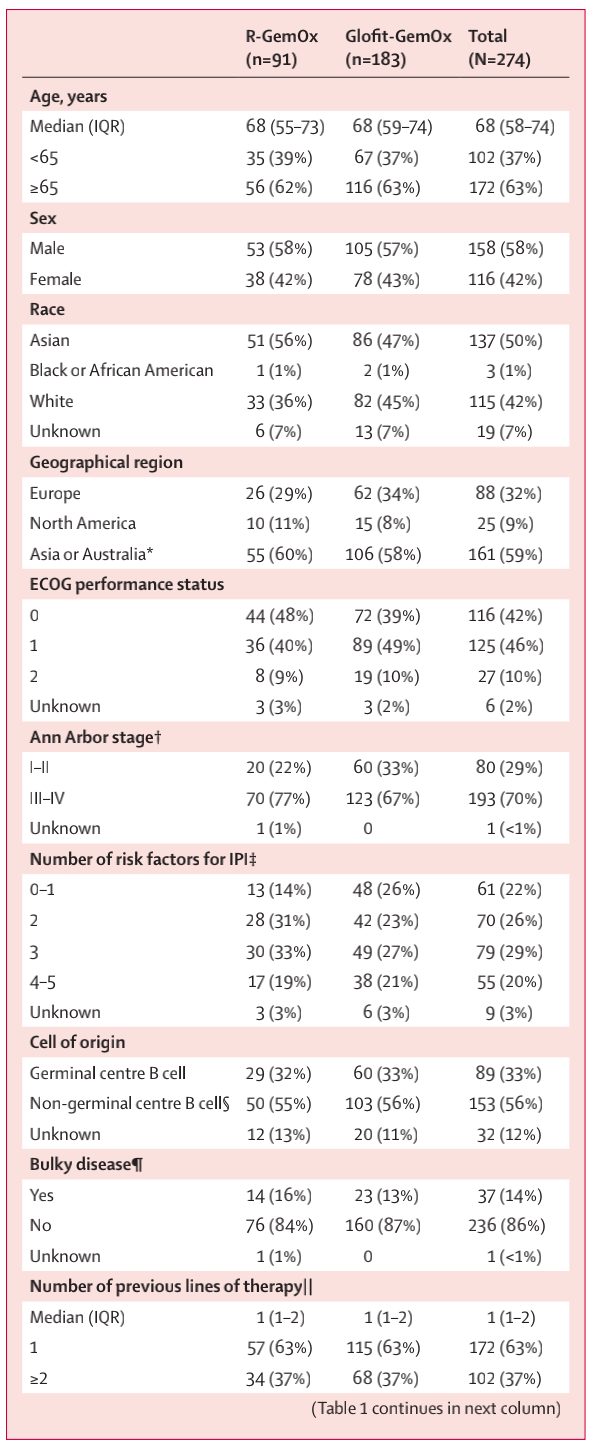
2021年2月23日至2023年3月14日,共274例患者被纳入并随机分配(Glofit-GemOx组:183名患者;R-GemOx组:91名患者;见图1)。158例(58%)为男性,116例(42%)为女性,中位年龄68岁(IQR 58 -74),73%的患者为Ann Arbor III–IV期,49%为IPI 3-5分(表1)。在Glofit-GemOx组,183名患者中有172名(94%)接受了Glofitamab治疗,中位治疗周期数为11.0(IQR 4–12)。在R-GemOx组,91名患者中有88名(97%)接受了利妥昔单抗治疗,中位治疗周期数为4.0(IQR 2–8)。
图1 试验流程图
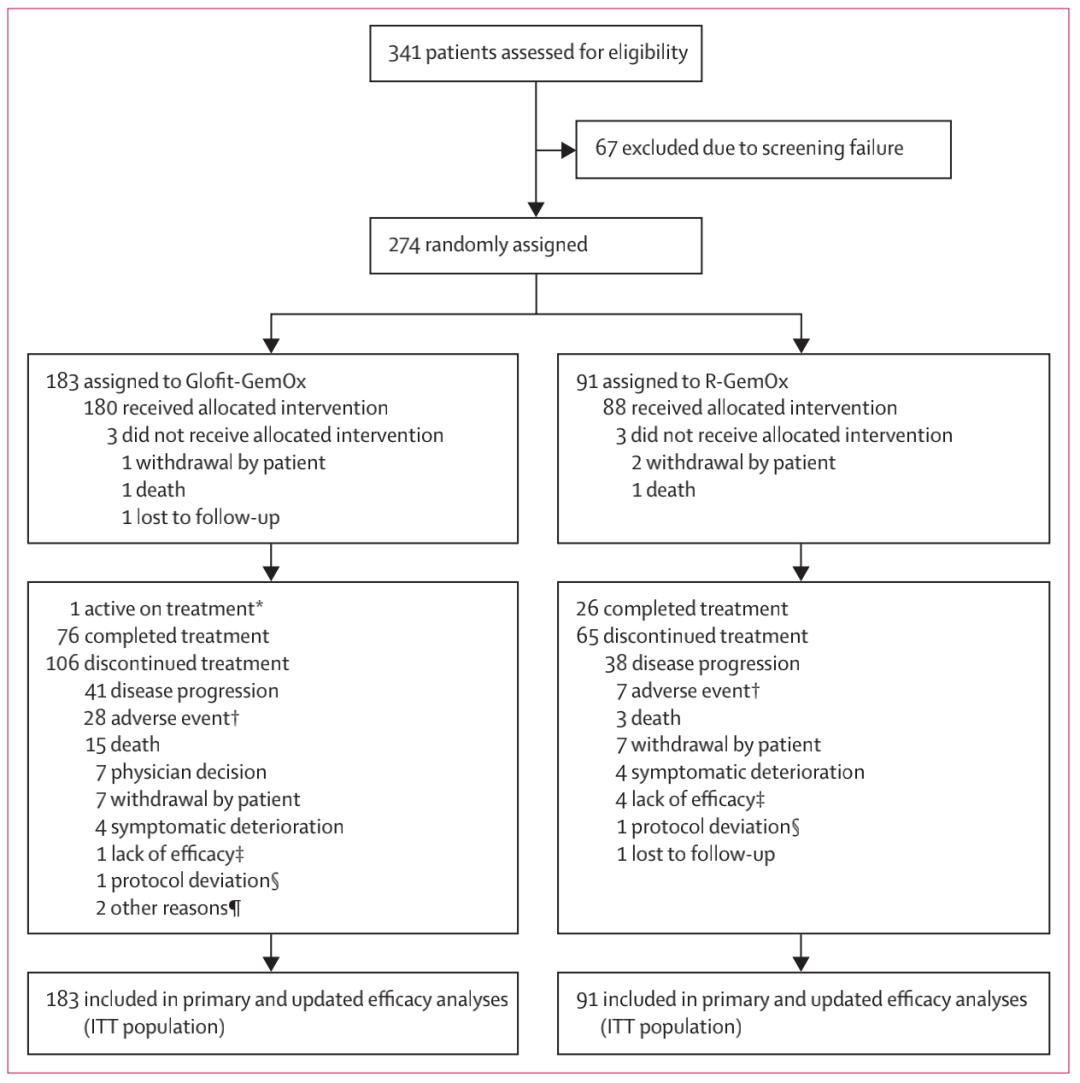
表1 基线人口统计学和临床特征
中位随访11.3个月的初步分析中,中位总生存期在Glofit-GemOx组显著长于R-GemOx组(NE [95% CI 13.8–NE] vs. 9.0月[7.3–14.4];HR 0.59,p = 0.011)。
中位无进展生存期在Glofit-GemOx组也显著长于R-GemOx组(12.1月vs. 3.3月;HR 0.37,p < 0.0001)。完全缓解率在Glofit-GemOx组显著高于R-GemOx组(50.3% vs. 22.0%;p < 0.0001)。
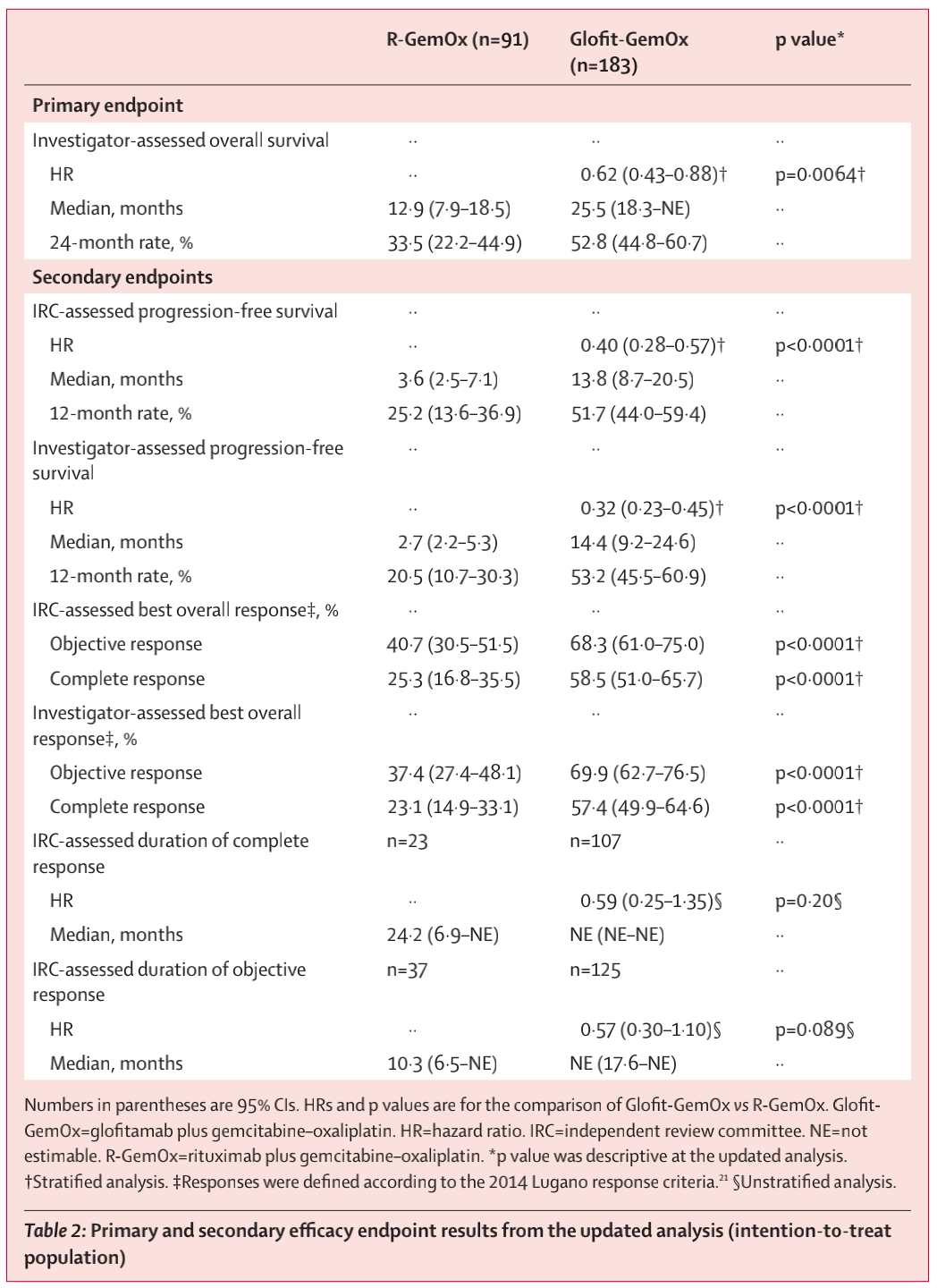
在中位随访20.7个月的最新分析中,Glofit-GemOx组的中位总生存期为25.5个月(95% CI 18.3–未达到),而R-GemOx组为12.9个月(95% CI 7.9–18.5);HR 0.62(图2A、表2)。中位无进展生存期在Glofit-GemOx组和R-GemOx组分别为13.8个月和3.6个月(图2B、表2)。R-GemOx组的疾病进展率显著高于Glofit-GemOx组(R-GemOx:39.6% vs. Glofit-GemOx:18.6%)。Glofit-GemOx组和R-GemOx组的完全缓解率分别为58.5%和25.3%,客观缓解率分别为68.3%和40.7%。完全缓解持续时间分别为未达到和24.2个月(HR=0.59)(图2C,表2),中位客观缓解持续时间分别为未达到和10.3个月(HR 0.57)。
图2 总生存期、无疾病进展生存期、完全缓解持续时间生存分析
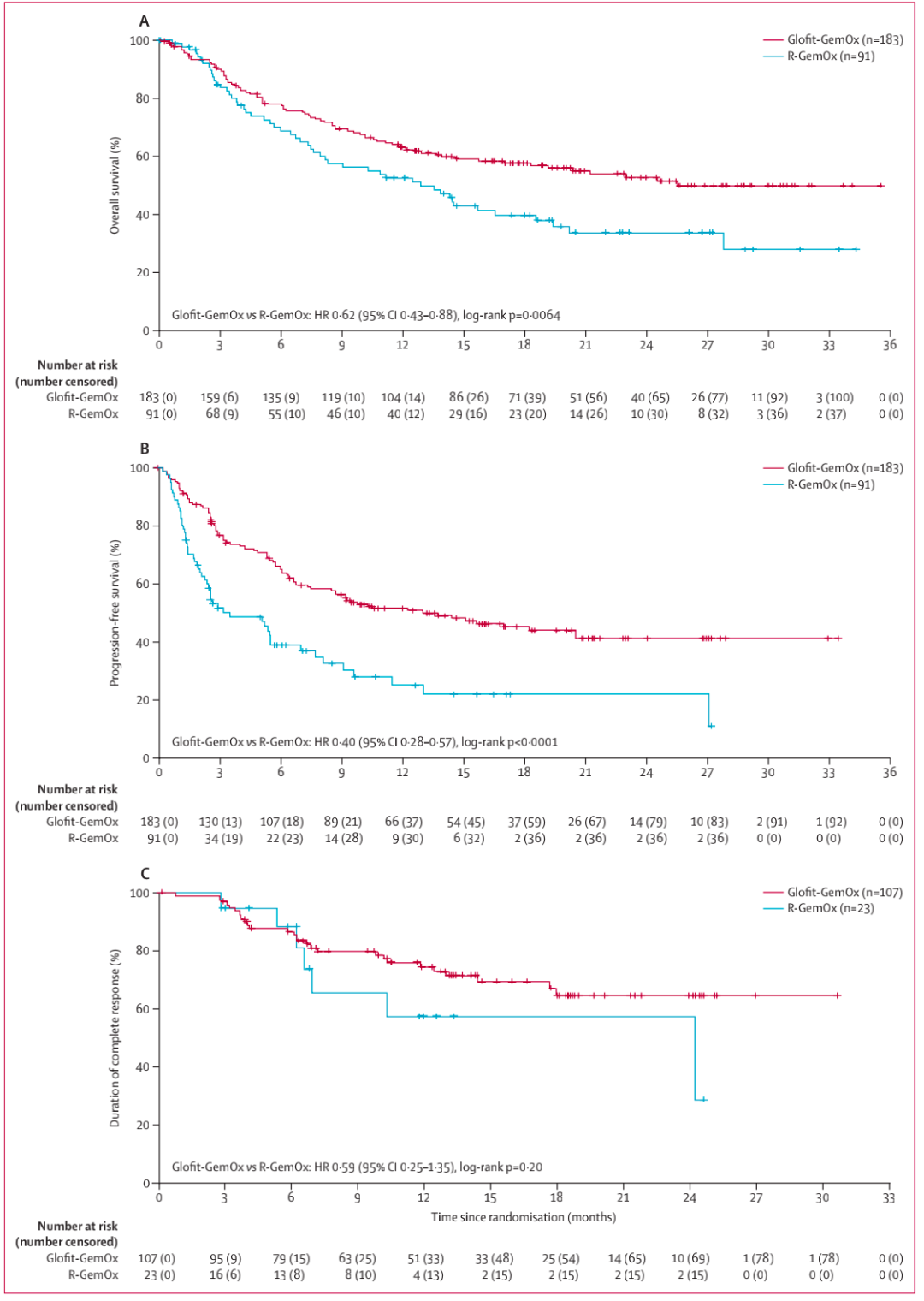
表2 最新分析的主要和次要疗效终点结果
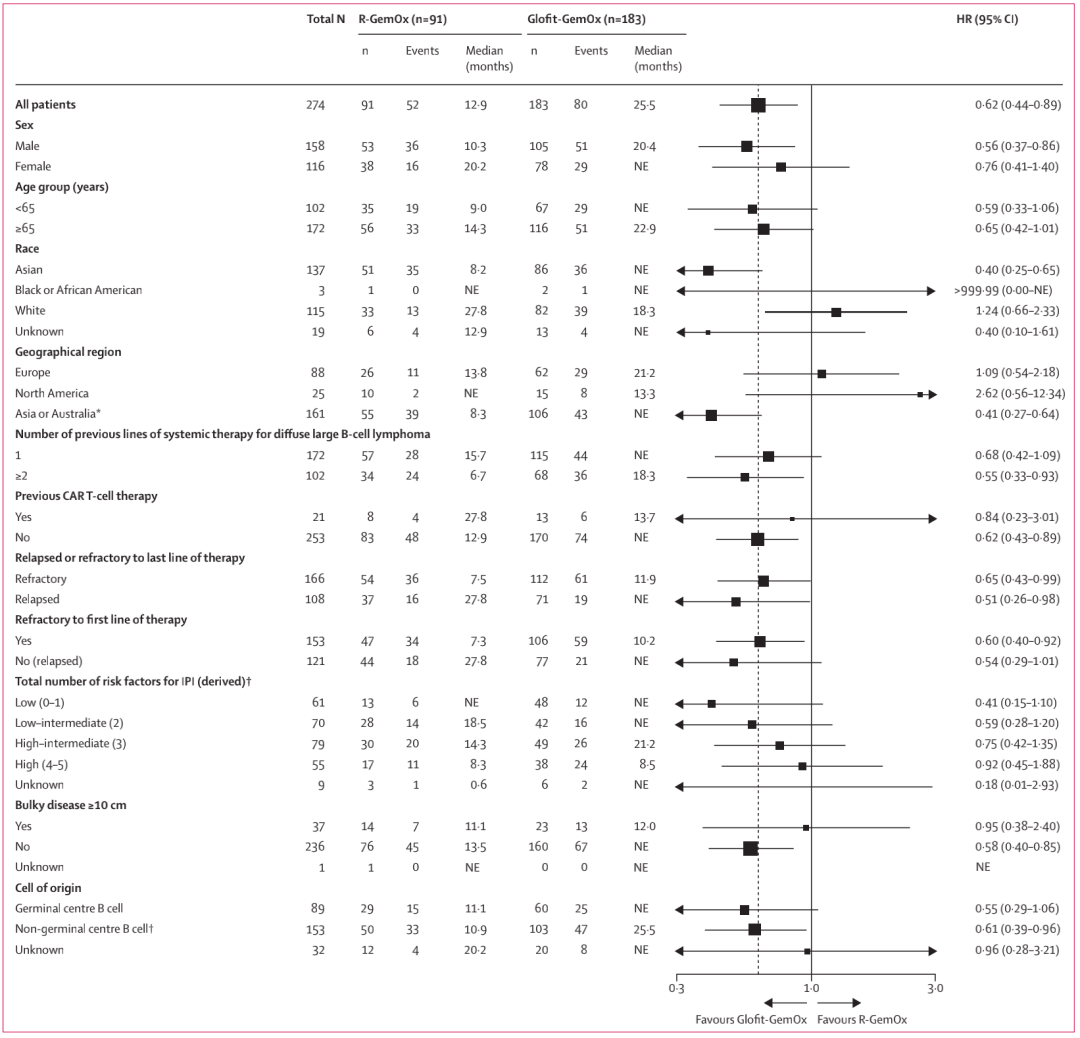
更新分析中的预设总生存期亚组分析显示,在按前期治疗线数(1线 vs. ≥2线)和最后一次全身性治疗结局(复发 vs. 难治性)分层的临床相关亚组中,Glofit-GemOx组具有更好的结果。在人种和地理区域亚组中观察到总生存期的存在不一致性(图3)。在纳入Glofit-GemOx组的183例患者中,13例(7%)接受过既往CART细胞疗法,并且对既往CART细胞疗法无效。在最新的分析中,这些患者的完全缓解率为53.8%,中位无进展生存期为8.4个月。在R-GemOx组中,91例患者中的8例(9%)既往接受过CART细胞治疗(2例患者复发,6例CART细胞疗法无效)。患者的完全缓解率为37.5%,中位无进展生存期为7.8个月。
图3 更新分析中,根据基线危险因素对总生存期进行了预设的亚组分析
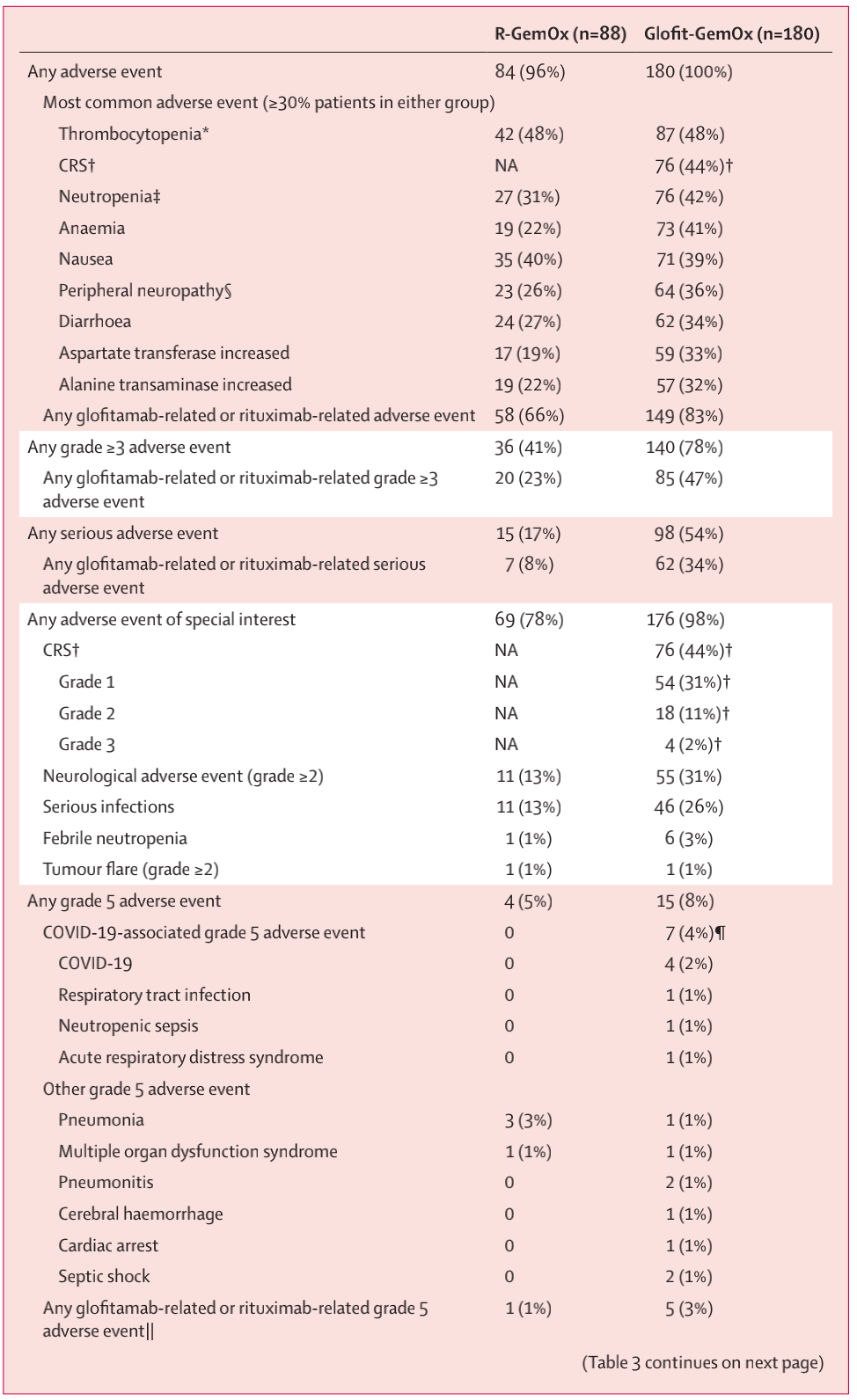
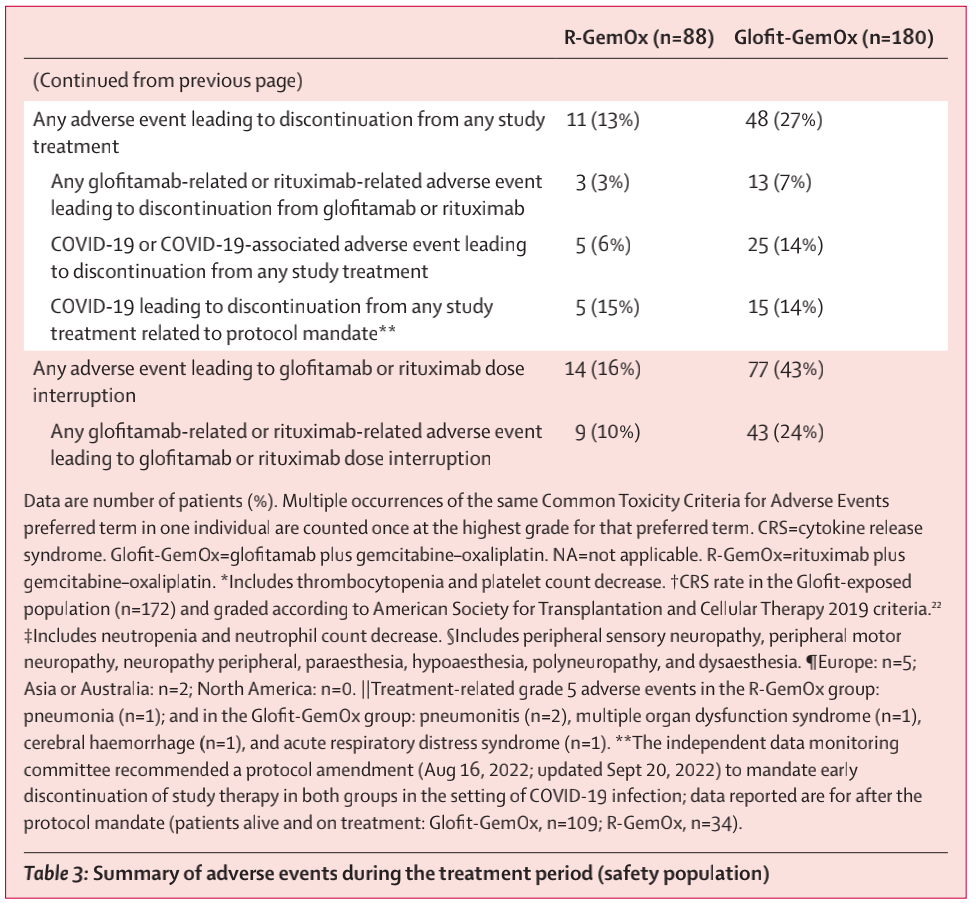
在安全性分析中,Glofit-GemOx组和R-GemOx组中分别有180名患者(100%)和84名患者(96%)发生至少一种不良事件,有98名(54%)和15名(17%)发生至少一种严重不良事件,有48名(27%)和11名(13%)因不良事件中止任何研究药物(表3)。19名患者因不良事件死亡(Glofit-GemOx组:15名(8%);R-GemOx组:4名(5%);表3)。特殊关注的不良事件包括细胞因子释放综合征(CRS)、神经系统不良事件、严重感染、发热性中性粒细胞减少和肿瘤爆发(表3)。在172例接受过Glofitamab单抗治疗的患者中,76例(44%)发生了CRS。CRS事件多为低级别(1级:54例(31%);2级:18例(10%);3级:4(2%))。4例(2%)Glofit-GemOx受者报告了免疫效应细胞相关神经毒性综合征(ICANS)事件;大多数患者为1-2级(3例(2%)患者),1例(1%)患者发生3级事件(谵妄)。所有ICANS事件均与CRS同时报告,并且随着CRS消退而消退。在Glofit-GemOx组中,7例(4%)患者发生了致死性COVID-19或与COVID-19相关的致死性不良事件。R-GemOx组无患者发生与COVID-19相关的致死性不良事件(表3)。
表3 治疗期间不良事件
研究结论
与R-GemOx相比,Glofit-GemOx显著改善了总生存期、无进展生存期和完全缓解率,支持其用于接受过至少一次治疗且不适合移植的复发或难治性弥漫大B细胞淋巴瘤患者。
参考文献
[1] Abramson JS, Ku M, Hertzberg M, et al. Glofitamab plus gemcitabine and oxaliplatin (GemOx) versus rituximab-GemOx for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomised, open-label trial. Lancet. 2024;404(10466):1940-1954. doi:10.1016/S0140-6736(24)01774-4.


