Adv Sci:深圳大学林静团队研究利用可激活的异二聚体前药酶组合实现多种治疗药物的自增强可编程释放,用于抗肿瘤治疗
时间:2024-11-24 12:00:52 热度:37.1℃ 作者:网络
内源性刺激反应性前药因其病变特异性和降低全身毒性而被广泛用于抗肿瘤治疗。然而,在肿瘤微环境(TME)中,作为经典内源性刺激的活性氧(ROS)不足以实现预期的药物释放。
2024年11月21日,深圳大学林静团队在Advanced Science 在线发表题为“Self-Boosting Programmable Release of Multiple Therapeutic Agents by Activatable Heterodimeric Prodrug-Enzyme Assembly for Antitumor Therapy”的研究论文。该研究开发了一种可ROS激活的异二聚体前药负载酶组件,用于多种治疗剂的自我促进可编程释放。
异二聚体前药NBS-TK-PTX(即NTP)由5-(乙胺)-9-二乙胺苯并[a]氯吩噻嗪类似物(NBS)、紫杉醇(PTX)和ROS响应型硫酮(TK)连接物组成,与葡萄糖氧化酶(GOx)表现出较强的结合亲和力,从而获得NTP@GOx组装。值得注意的是,NTP@GOx中GOx的酶活性被NTP抑制。可编程释放是通过以下步骤实现的:i) NTP@GOx在酸性TME中部分解离,从而释放一小段NTP和GOx。因此,GOx的酶活性被恢复;ii) GOx触发的pH降低进一步促进NTP@GOx的解离,从而加速NTP和GOx的大量释放;iii)药前NTP的TK连接被GOx催化生成的过氧化氢劈裂,分别加速了用于Ⅰ型光动力治疗的NBS和用于化疗的PTX的释放。NTP@GOx显示了多模式协同癌症治疗的巨大潜力。

化疗是一种传统的癌症治疗方法。然而,化疗药物由于无法区分正常细胞和肿瘤细胞,通常具有高度毒副作用。利用肿瘤代谢不规律的特点,在缺氧、过表达酶、酸性、活性氧(ROS)等内源性刺激的基础上,探索了肿瘤微环境(TME)反应性前药。其中,ROS作为关键代谢产物引起了人们的极大兴趣。到目前为止,已经开发出一系列ROS敏感基团(如硫化丙烯、硼酸酯、硫酮、碲、硒、二茂铁和花青素)来构建ROS活化的前药。然而,TME中ROS的含量不足以达到预期的药物释放。因此,开发具有自增强特性的ROS活化前药是一个很大的挑战。
葡萄糖氧化酶(GOx)诱导的饥饿疗法在癌症治疗中显示出巨大的潜力,其中GOx特异性催化β-D-葡萄糖氧化产生大量过氧化氢(H2O2)。H2O2水平的升高可能会提高ROS活化前药的活化效率。然而,氧化过程中氧气(O2)被消耗,导致肿瘤严重缺氧,从而削弱了O2依赖型抗肿瘤药物的疗效,如Ⅱ型光敏剂(PSs)。相比之下,Ⅰ型PSs由于其对O2的依赖性较低,是很好的候选者。例如,5-(乙基氨基)-9-二乙基氨基苯并[a]吩噻嗪氯类似物(NBS)作为Ⅰ型PS用于光动力治疗(PDT),在660 nm激光照射下,即使在低氧水平下,也能通过Haber Weiss/Fenton反应产生超氧自由基(O2−•)。因此,GOx与不依赖O2的ROS激活前药联合使用可以促进药物释放,实现饥饿与其他治疗的有效协同。
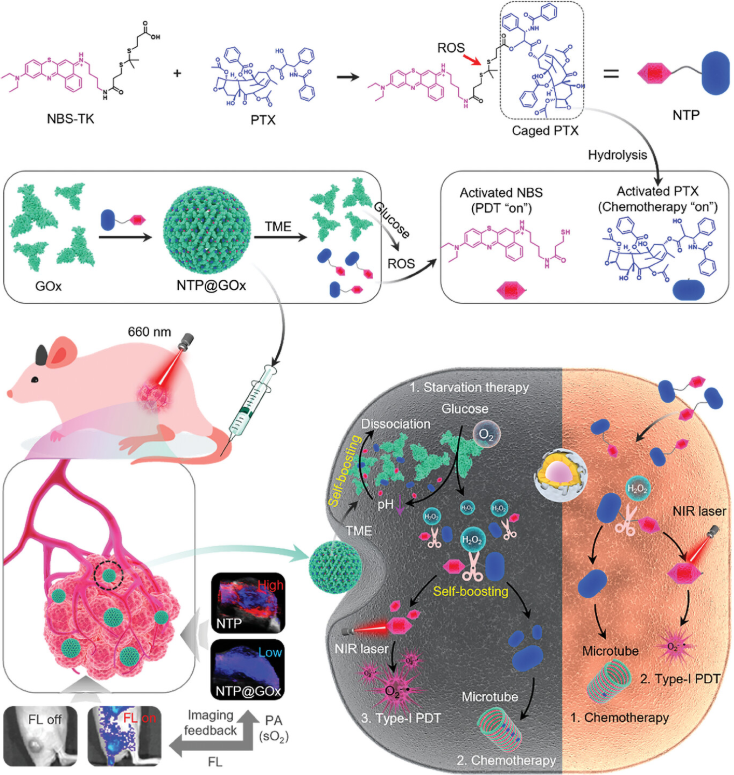
ROS可激活异二聚体前药负载酶组装(NTP@GOx)的示意图(图源自Advanced Science )
研究开发了一种可ROS激活的异二聚体前药负载酶组件,用于多种治疗剂的自我促进可编程释放。异二聚体前药NBS-TK-PTX(即NTP)由NBS、紫杉醇(PTX)和ROS响应型硫酮(TK)连接物组成。NTP由于疏水相互作用与GOx表现出很强的结合亲和力(−8.1 kcal mol−1),从而获得NTP@GOx组装。值得注意的是,NTP@GOx中GOx的酶活性被NTP抑制。可编程释放是通过以下步骤实现的:i) NTP@GOx在酸性TME中部分解离,从而释放一小段NTP和GOx。因此,GOx的酶活性恢复;ii) GOx触发的pH降低进一步促进了NTP@GOx的解离,从而加速了NTP和GOx的大量释放;iii)药前NTP的TK连接被GOx催化产生的H2O2切割,从而分别加速了NBS在Ⅰ型PDT和PTX化疗中的释放。在荧光(FL)和光声(PA)双模成像导航下,NTP@GOx显示出GOx介导的饥饿治疗、PTX诱导的化疗和基于NBS的Ⅰ型PDT的协同治疗效果。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202409960


