【ASCO继续教育】利用MRD优化AML、ALL和CML的管理
时间:2023-07-06 07:07:26 热度:37.1℃ 作者:网络
AML、ALL和CML是一种异质性疾病,其预后差异很大且与疾病和患者特征相关。治疗决策和预后均取决于患者的疾病状态,需要准确评估可测量残留病灶 (MRD)。MRD 定义为治疗后白血病细胞以低于形态学检测的水平持续存在,低于一定阈值的 MRD 与白血病患者较长的无进展生存期 (PFS) 和总生存期 (OS) 相关,因此MRD越来越多地被用作临床试验的次要终点。
ASCO继续教育文集近日发表的一篇文章中,作者综述了 MRD 的使用及其在AML、ALL和 CML 患者中的临床意义。整理主要内容如下供各位老师参考。

MRD检测技术
MRD 评估技术包括多参数流式细胞术 (MFC)、定量聚合酶链反应 (qPCR) 或二代测序 (NGS),可通过外周血或少量首次抽取骨髓(以避免血液稀释)用于 MRD 评估。对于每种白血病类型,MRD通常在初始治疗后、治疗期间的系列检测以及治疗完成后的随访期间进行评估,但MRD评估方法之间存在显著差异,每种白血病亚型的敏感性也不同。下文简要讨论了每种 MRD 评估方法在白血病类型中的灵敏度、优点和缺点,并总结在表1中。MRD 阴性或检测不到的 MRD 是指 MRD 结果低于推荐的预后阈值,下文讨论了各种疾病的该阈值(另见图1-3和表1)。MRD 可在低于预后阈值但高于分析检测限的情况下检出。不同的MRD检测方法讨论如下。
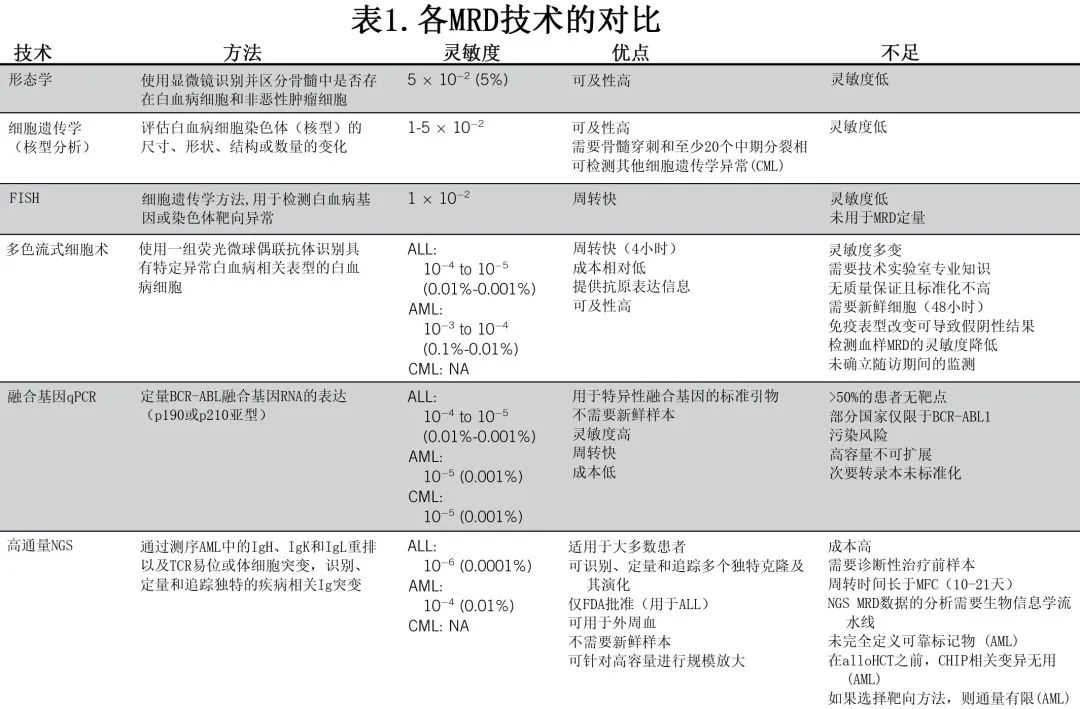
AML的分子和免疫学异质性需要为特定患者人群量身定制 MRD 评估方法(图1)。根据美国国家综合癌症网络 (NCCN) 和欧洲白血病网 (ELN),AML MRD评估的第一步应关注分子学突变,如使用 qPCR 检测的 NPM1 和融合癌基因。尽管基于分子 qPCR 的技术很敏感,但它们的缺点是只能应用于携带这些基因突变的患者子集。如果这些突变缺失,而存在特定的免疫表型,则可以使用MFC。虽然 NGS 可以对 AML 患者具有预后价值的突变进行评估和定量,但由于其缺乏标准化和靶点突变验证不完整,目前在常规临床实践中还不推荐作为独立技术。为了前瞻性地使用 MRD 作为预测性生物标志物,对所有实验室的 MRD 进行标准化非常重要,ELN-DAVID MRD 网络和美国国立卫生研究院 (FNIH) 生物标志物联盟基金会正在非常积极地促进所有 MRD 检测的标准化,从而产生了一个外部质量评估 (EQA) 计划,该计划由英国国家外部质量评估服务 (UK-NEQAS) 每季度提供一次,所有实验室均应遵循。
ALL 中的 MRD 多通过MFC(灵敏度为10-4)、费城染色体阳性 ALL 患者的qPCR(Ph+ ALL;灵敏度为10-4-10-5)或NGS(灵敏度为10-6;表1)进行评估。NCCN 指南指出,ALL的 MRD 检测必须具有至少10-4的灵敏度;而新出现的数据表明,更灵敏的方法在预测 ALL 患者的结局方面更优。
鉴于这些结果,美国大多数学术中心现在正在纳入基于 NGS 的 MRD 监测平台。FDA批准的一种基于 NGS 的检测目前在美国可用,其跟踪 B-ALL 中的免疫球蛋白 H(IgH) 重排和 T-ALL 中的 T 细胞受体基因重排,约90%的患者有可追踪的克隆;该检测方法不存在克隆偏倚,意味着其可以在新克隆随时间出现时检测到。
此外,有证据表明,血液中的 NGS-MRD 监测具有与骨髓相似的灵敏度,可更频繁的监测且不需要侵入性操作。NGS 的主要缺点包括需要大量的细胞、成本和较长的周转时间可能会延误临床决策。相比之下,MFC广泛可用、相对便宜、结果可快速获得;但在美国尚无标准化的 MFC 检测,各中心的灵敏度并不同。
CML 残留病变的检测相对简单,因为所有白血病细胞均携带BCR::ABL1融合癌基因,它是t(9;22)(q34;q11) 相互易位的产物。一旦患者获得血液学完全缓解,可在常规实践中通过可靠技术(包括常规细胞遗传学和分子生物学)检测残留的白血病细胞。细胞遗传学和分子学 MRD 监测均可在个体水平上提供关键的预后信息,在患者管理和决策中起着至关重要的作用;但定期通过核型分析进行 MRD 评估直至获得完全细胞遗传学缓解 (CCyR)正趋于消失,这有利于分子生物学技术。使用金标准定量 qPCR 技术,通过扩增外周血BCR:ABL1转录本和 ABL1 或 GUS 作为对照基因,对 MRD 进行基于分子的定量,灵敏度为10-4.5至10-5。因此在诊断时描述BCR::ABL1转录本类型的特征至关重要。事实上,对于大多数携带主要类型 e14a2 或e13a2 BCR::ABL1转录本的患者,均使用了结果以国际量表 (IS) 表示的标准化检测,但这些检测并非设计用于具有非典型转录本的罕见患者。BCR:ABL1点突变是一种众所周知的酪氨酸激酶抑制剂 (TKI) 获得性耐药机制,可以使用 Sanger 测序检测和表征,灵敏度限度为10%-20%,而NGS 技术在常规实践中趋于取代 Sanger 测序,因为灵敏度更高,能够检测低水平突变(尽管有错误的风险),并能区分多克隆突变和复合突变体。
下文讨论AML、ALL和 CML 中 MRD 检测相关的临床相关性和医疗决策。
AML中MRD的临床作用
AML中的MRD监测:临床建议
完全缓解 (CR) 或 CR 伴血液学不完全恢复的 AML 患者可通过 MRD 进一步改善预后,MRD阴性患者的5年中位 OS 为68%,MRD阳性患者为34%。AML 的所有 MRD 技术和不同时间点的预后效果均已得到确认,例如化疗2个周期后、治疗结束时、异基因造血细胞移植 (alloHCT) 前和随访期间。但年龄和疾病特征(如遗传畸变和治疗特征)同样会影响达到 MRD 阴性的可能性。因此,在当前 ELN 风险分类的背景下评估 MRD 的预后价值非常重要,该分类规定了 MRD 技术、时间点、组织和使用 MRD 作为 AML 患者预后生物标志物的临界值(图1)。重要的是,一项大型回顾性研究证实了 MFC-MRD 在三个 ELN 风险组中的预后重要性。
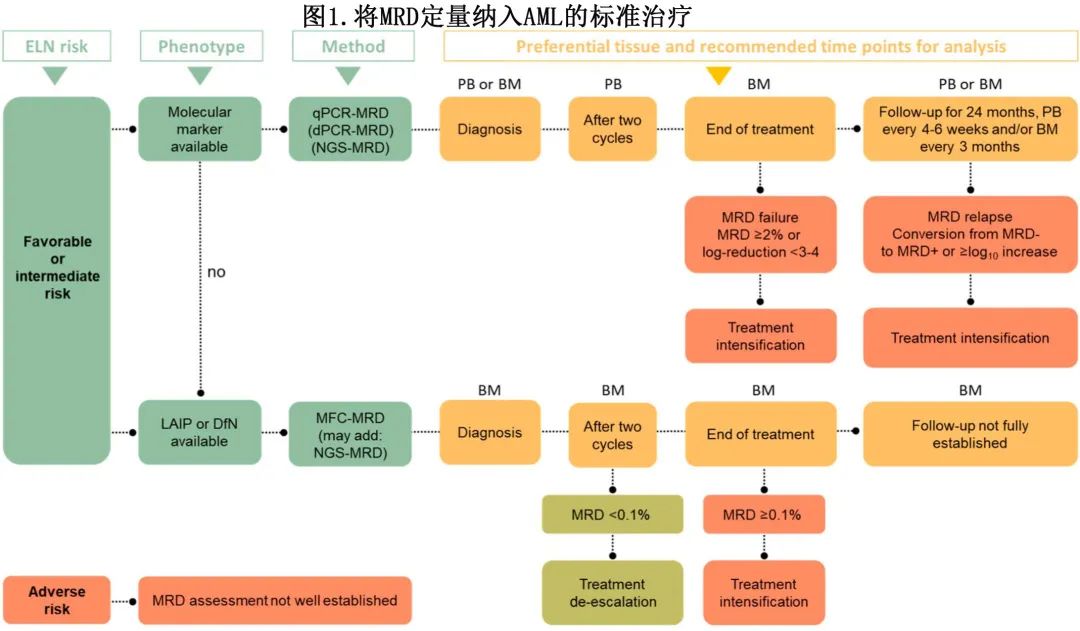
临床医生常将 MRD 结果作为预后标志物,然而MRD在为 AML 患者选择治疗方案方面的预测作用仍在演变,目前最重要的临床问题是 MRD 是否有助于将患者分配至化疗巩固治疗或alloHCT。该问题首先在一项意大利研究中得到解决,在该研究中,MFC-MRD指导了 NCCN 定义的中危 AML 患者的移植决策:MRD阴性患者建议接受化疗巩固治疗或自体移植,而 MRD 阳性患者建议接受alloHCT。结果MRD 阴性和 MRD 阳性患者的无病生存期和 OS 相同,表明风险分层的巩固治疗策略一方面克服了 MRD 的不良预后效应,另一方面可以使相当数量的患者免于 alloHCT 相关毒性。HOVON 132 研究也应用了类似的风险分层巩固方法,接受大剂量化疗和自体移植巩固治疗的 MRD 阴性患者的结局与接受 alloHCT 的 MRD 阳性患者的结局相似;表明MRD在 ELN 中危组中不再具有预后效应,相当数量的 MRD 阴性患者中alloHCT可以幸免。
Congxiao Zhang等在 ELN 风险组背景下,调查了769例在两个化疗周期内达到 CR 的患者中alloHCT的作用。在 ELN 低危和中危组中,MRD阴性患者未从移植中获益,但MRD阳性患者使用 alloHCT 具有高度显著的生存获益。化疗2个周期后评估时,低危组的 MFC-MRD 无预后意义,而接受 alloHCT 的患者 OS 改善且与 MRD 状态无关。这些数据导致 ELN的MRD 建议,CR患者标准诱导化疗2个周期后测量的 MFC-MRD 是指导巩固策略的预测性生物标志物(图1)。但尚缺乏证明该方案的前瞻性研究,且目前没有比较 MRD 引导与 MRD 非引导方案的数据。
AML中最佳的MRD转换策略?
与 MRD 阴性患者相比,接受 alloHCT 的 MRD 阳性患者的复发率较高、OS较短,从而提出了一个问题,即在接受 alloHCT 前MRD阳性患者是否应通过额外治疗转化为 MRD 阴性?新出现的数据有助于澄清这一问题。Paras 等发表了一项大型回顾性研究,包括在 CR1 或 CR2 中接受 alloHCT 的810例患者,在 alloHCT 前后用 MFC-MRD 评估MRD。序贯 MRD 评估显示,在 alloHCT 前的161例 MRD 阳性患者中,118例在 HCT 后变为 MRD 阴性,相当于 alloHCT 的 MRD 转化率为73%。alloHCT 前后均为 MRD 阴性的患者复发发生率最低、OS最高。重要的是,MRD 阳性患者转化为 MRD 阴性的的复发率显著低于 alloHCT 前后均为 MRD 阳性患者,OS也显著延长。因此,alloHCT目前是唯一显示生存获益的 MRD 转换治疗。采用 NGS 评估 MRD 时发现alloHCT 的 MRD 转化率为60%-74%,也包括 OS 的改善。
lloHCT之外也探索了 MRD 转换。一项前瞻性 II 期研究使用维奈克拉和低剂量阿糖胞苷治疗MRD升高的NPM1突变患者,结果69%的患者达到 MRD 缓解,54%变为 CR MRD 阴性;中位随访18个月,2年 OS 为72.6%,EFS为55.4%。Othman 等的一项回顾性研究评估了 FLT3 抑制剂在分子学失败患者中的转换疗效,接受一种可用 FLT3 抑制剂治疗的49例可评估患者中有63%产生应答,其中45%达到完全缓解;既往接受过 alloHCT 的患者分子学缓解 (MR) 率为93%,而既往未接受 alloHCT 的患者为50%;中位随访24.2个月,2年 OS 为79%。总之,MRD 阳性患者直接 alloHCT和MRD 复发患者接受维奈克拉/阿扎胞苷或 FLT3 抑制剂的MRD 转化率相似。目前来说,MRD 阳性患者直接进行 alloHCT 并在移植后使用 FLT3 抑制剂治疗(在 FLT3 突变患者中)似乎是合理的,而正在进行的 alloHCT 后维奈克拉/阿扎胞苷维持治疗研究的结果应该等待,基于结果考虑MRD 阳性AML 患者是否在 alloHCT 后常规使用。少数患者在诱导化疗后可能为 MRD 阴性,并在 alloHCT 前直接转 MRD 阳性,这些患者很可能患有侵袭性疾病,可以考虑在 alloHCT 之前进行替代治疗。
不适合强化化疗的AML患者的MRD
几项研究评价了 MRD 在非强化治疗AML 患者中的预后作用。维奈克拉和克拉屈滨联合阿扎胞苷或低剂量阿糖胞苷的随机研究最常评估 MRD 与MFC-MRD;用 MFC-MRD 时60%-71%的患者为 MRD 阳性,而使用分子学方法71%-100%的患者为 MRD 阳性。MRD对无复发生存期 (RFS) 和 OS 具有高度预后性,MRD阴性患者的中位 RFS 为16.2个月,而 MRD 阳性患者为7.05个月;MRD 阴性患者的中位 OS 为26.2个月,而 MRD 阳性患者为13.8个月。目前正在评价 MRD 检测的适当时间点和对治疗指导的潜在影响。在 Viale-A 试验中,在第1周期后MRD 阴性患者为25%,第4周期后27%,第7周期后27%,此后为21%。然而接受地西他滨和维奈克拉10 天治疗后2个月为MRD 阳性患者的中位 EFS 仅为5.8个月,中位 OS 为7.1个月,因此在4-7个周期的去甲基化药物联合维奈克拉治疗后 MRD 阳性的患者群应制定额外的治疗策略以降低复发风险。
ALL中MRD的临床作用
ALL中MRD的预测价值
MRD 是儿童和成人 ALL 结局和复发风险的强预测因子。一项荟萃分析包括39项研究,超过13000例成人和儿童 ALL 患者,MRD与 EFS 和 OS 改善一致相关。在成人和儿童 ALL 中使用 MRD 检测的横断面医生调查显示,93%的儿科医生和53%的成人医生使用 MRD 作为标准方案。Short 等在一项中等规模的单中心研究(74例患者)中评估了高灵敏度 NGS 的临床影响,证明许多 MFC 检测为 MRD 阴性的患者仍存在具有临床意义的MRD,可通过超灵敏 NGS 检测到:所有经 MFC 检测为 MRD 阳性的患者经 NGS 检测也为 MRD 阳性,MFC 检测为 MRD 阴性的样本中46%经 NGS 检测为 MRD 阳性;此外NGS 检测 MRD 阴性患者在诱导治疗后均未复发。在斯坦福大学或俄勒冈健康与科学大学接受 HCT 的成人 ALL 患者 (n=157) 的更大多中心队列研究证实了超灵敏 NGS MRD 监测的重要性,Liang等证实,HCT 前MRD可检测,即使在10-6的低水平和HCT 后任何时间可检测到 MRD,也会增加 HCT 后复发的风险;而移植后前2年内,HCT前 MRD阴性且 HCT 后 MRD 仍阴性的患者结局极佳(复发可能性为10%)。这些结果与既往儿科的报道一致。Sekiya 等发现,在儿童 B-ALL 中基于 NGS 的 MRD 监测可预测无白血病生存期。Wood等的另一项研究表明,NGS检测 MRD 可改善儿童 B-ALL的风险分层。Gokbuget等使用MRD引导治疗,强化化疗后>10-3 MRD的患者给予贝林妥欧单抗,1周期后80%的患者达到MRD<10-4,且达到 MRD 阴性的患者中位OS未达到。
MRD 测量也可预测接受CAR T 细胞治疗的 B-ALL 患者的复发。在接受 tisagenlecleucel 治疗的儿童和年轻成人患者中,第28天或第3个月未达到 MRD 阴性与不良结局相关。MRD 评估的敏感性也可预测结局,MRD 阴性水平为10-4、10-6和低于10-6时,复发风险分别为50%、31%和0%。
ALL中的MRD监测:临床建议
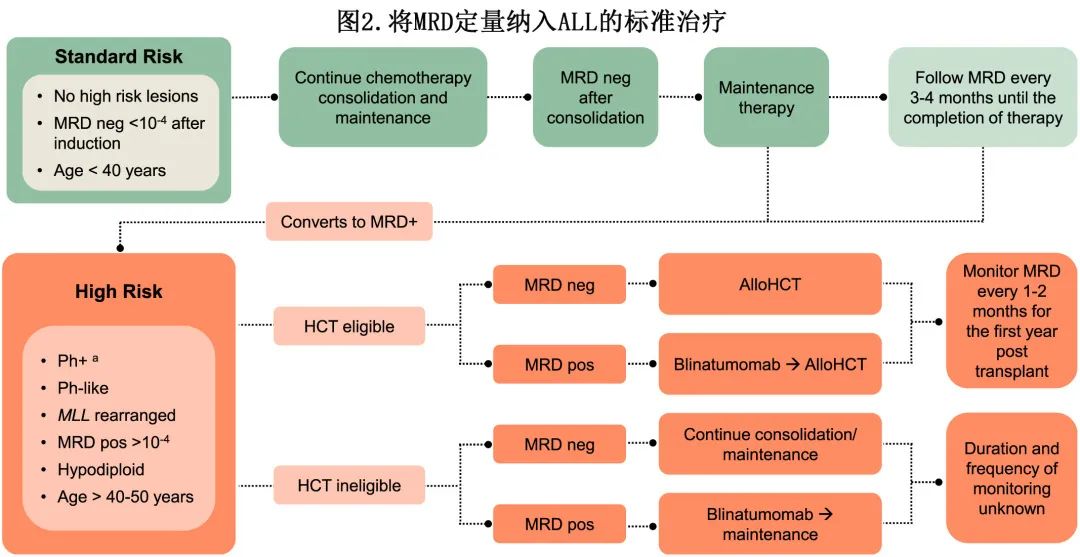
图2显示了如何将 MRD 定量纳入 ALL 患者的标准治疗。作者建议确定用于 MRD 跟踪的患者特异性免疫表型或克隆型,包括在基线时、诱导、巩固和延迟强化治疗后以及整个维持治疗过程中每3-6个月。对于接受 alloHCT 的患者,建议移植前评估 MRD,然后在移植后前45天内通过血液或骨髓进行连续监测,然后在移植后1年内每1-2个月进行一次。NGS 的高灵敏度允许在外周血中进行 MRD 定量,似乎是一种充分的替代方法,与移植后频繁的骨髓评估相比可实现更频繁的监测。标危ALL 患者如果适合儿科诱导方案治疗,并且 MRD 在10-4水平阴性,应该继续化疗、巩固和维持治疗;如果转化为 MRD 阳性,应与高危 ALL 患者接受相似的治疗。CR的高危 ALL 患者(Ph+、Ph样、MLL重排、亚二倍体、早期 T 细胞前体 (ETP)-ALL、MRD阳性>10-4)应评估 HCT 合格性;适合接受 HCT 的 MRD 阳性患者应在移植前接受贝林妥欧单抗治疗,而 MRD 阴性患者无需接受贝林妥欧单抗治疗。但应注意,尚未在随机化临床试验中研究使用贝林妥欧单抗清除移植前MRD,也不太可能进行此类试验。不适合 HCT 的高危 MRD 阴性患者应继续巩固和维持治疗;不适合 HCT 的高危 MRD 阳性患者应该接受贝林妥欧单抗治疗,然后继续维持治疗。目前尚无药物获批用于治疗 T-ALL 患者的MRD,仍是未满足的临床需求。在Ph+ ALL成人患者中,尚不清楚是否应使用 BCR-ABL qPCR 或 NGS 检测的 MRD 来监测疾病;,通过 NGS 和 BCR-ABL qPCR 测量 MRD 可能有助于识别复发风险极低的患者或识别疾病进展风险较高的患者。此外患者经 NGS 检测为 MRD 阴性,但 BCR-ABL 为持续阳性,然而该组的临床意义尚不清楚。研究正在进行中,以确定 NGS 与 BCR-ABL qPCR 在Ph+ ALL成人中的相对特异性以及不一致 MRD 结果的预后意义。
值得注意的是,应在特定基因型和克隆型背景下评估MRD。例如,Jeha等通过在诱导缓解期间使用基因组分析和 MRD 评估检查了儿科 ALL 中白血病亚型的预后意义,结果表明,如果准确地将 ALL 儿童分为风险组,基因组分析和 MRD 测量都是必要的。Liang 等人最近评估了 NGS MRD 检测的各种克隆型(例如IgH vIg/Ig)在成人 B 细胞 ALL 中的预后意义,表明HCT后检测到 IgH 克隆型(而非 Ig/Ig 克隆型)与复发风险增加有关。
CML中MRD的临床作用
CML中MRD的临床和预后意义
伊马替尼是首个治疗 CML 的TKI,可通过直接竞争性抑制 ATP 结合来特异性靶向BCR::ABL1癌蛋白活性。在伊马替尼开发过程中,该药物能够将这种致死性白血病转变为一种与接近正常寿命相似的疾病,可在骨髓细胞中期分裂相上带来早期和持久的费城染色体 (Ph1) 阴性,突出了细胞遗传学缓解对 TKI 时代 PFS 的关键预后价值。使用更灵敏的 MRD 检测技术,如通过 qPCR 定量外周血BCR::ABL1转录本,还发现 CCyR 中的大多数患者保留可检测的白血病细胞,但范围广泛且具有不同的临床意义。长期 PFS 率最高的患者为 CCyR 患者伴BCR::ABL1转录水平降低3个对数的患者。里程碑分析显示治疗期间BCR::ABL1转录下降程度与长期临床结局之间存在稳健相关性,从而支持使用时间依赖性分子学指标来确定治疗应答。从那时起,qPCR检测在灵敏度、可靠性和可重复性方面有均所改善,并在技术标准化方面做出了国际努力。鉴于无治疗缓解 (TFR) 对 TKI 停药决策的重要性,已准确定义了10-4或以下并降至10-5水平的深度分子学解 (DMR)。TKI 停药后的 MRD 水平还于预测和分子学复发(可触发 TKI 恢复)。目前,针对 CML 的治疗药物包括第一代 TKI 伊马替尼、三种第二代 ATP 竞争性TKI(博舒替尼、达沙替尼和尼洛替尼)、一种第三代 TKI ponatinib和一种选择性变构抑制剂asciminib。这一口服靶向药物库对于慢性期 (CP)-CML 患者的治疗目标至关重要。
CML中的MRD监测:临床建议
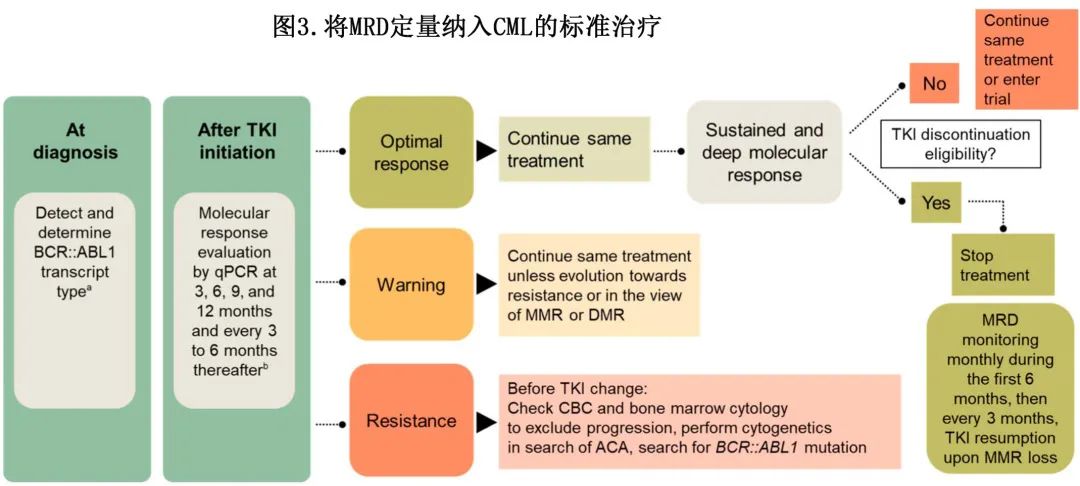
ELN 和 NCCN 均建议每3个月评估一次MR(图3)。BCR::ABL1 ≤10% (MR1) 相当于标准化白血病负荷较降低1个对数,BCR::ABL1 ≤1% (MR2) 是 CCyR 的分子学当量,相当于白血病负荷降低2个对数,BCR::ABL1 ≤0.1%(MMR或MR3)对应于白血病负荷降低3个对数,DMR 包括MR4 (BCR::ABL1 ≤0.01%)、MR4.5 (BCR::ABL1≤0.0032%) 和MR5 (BCR::ABL1 ≤0.0001%)。MR 是在特定时间点定义的,分为最佳、警告和耐药三类,应特别关注 TKI 治疗开始后的前3-12个月。最佳缓解者不需要调整治疗,除非有资格停用TKI;耐药要求根据BCR::ABL1激酶结构域 (KD) 突变分析的结果改变治疗;警告对应于治疗1年后BCR::ABL1转录本降低等于或低于1% IS水平,但未达到MMR。随着时间的推移,警告类别可能保持不变,或随着治疗持续时间的延长向耐药或最佳缓解演变;但在没有任何 TKI 治疗调整的情况下达到 DMR 水平的可能性较低。
长期 TFR 伴持续无治疗最佳 MR是目前 CML TKI 治疗的最优获益,而持续 DMR 是 TKI 停药的先决条件之一。安全停用 TKI 的 ELN 最低标准包括
(1) 处于第一慢性期 (CP) 的CML;
(2) 接受一线或二线TKI,前提是不耐受导致的治疗改变;
(3) 第一代 TKI 伊马替尼治疗至少5年或第二代 TKI 达沙替尼、尼洛替尼或博舒替尼治疗4年;
(4) 至少持续2年的≥MR4。TKI 停药的 NCCN 选择标准则不太严格:要求至少治疗3年,包括≥MR4至少持续2年。符合 TKI 停药条件的患者的长期 TFR 几率为50%,但长期 DMR与更好的 TFR 概率也相关。在 TKI 停药时,MRD监测是关键,因为复发定义为 MMR 丧失,可触发 TKI 恢复。一旦停用TKI,建议在前6-12个月每月监测一次MR,因为大多数分子学复发(约85%)发生在该时间范围内,并继续每3个月监测一次。
其他
MRD 检测很常见,但并不普遍。对治疗期间的MRD检查时间尚缺乏共识,而连续测量有助于降低 MRD 检查结果的歧义。三大 MRD 技术的周转时间差异较大:MFC-MRD 通常在采集骨髓样本的同一天进行评估;qPCR可以从冷冻组织材料中完成,因此通常储存多天直到采集到足够的样本进行 MRD 测定;NGS 通常也使用冷冻组织样本,目前的方法需要时间进行样本和文库制备、高覆盖度测序、生物信息学医学分析和报告。因此,MFC的结果速度最快,qPCR需要几天,NGS需要2-3 周。
MRD是多种预后标志物之一,有助于根据其他预后信息做出决策,但并非所有患者均可获得适当的 MRD 标志物,此外MRD技术因 AML 类型而异,MRD标志物也可能随时间而变化。两个治疗周期后,可基于 MRD 降低治疗强度,而在治疗结束和随访期间可基于 MRD 结果增加治疗强度。ALL 患者应该意识到 MRD 对临床决策的重大影响,治疗方案的变化、继续进行异基因干细胞移植的决策以及干细胞移植前给予多少治疗都是基于是否存在MRD。CML 患者应了解 MRD 可反映白血病细胞对 TKI 的敏感性,并影响治疗决策,因此定期进行高质量 MRD 监测非常重要。也应告知患者,由于技术方面可能导致BCR::ABL1转录本略微增加,这是qPCR检测的内在变异而无生物学和临床相关性,因为这可能导致焦虑。
参考文献
Dekker SE,et al.Using Measurable Residual Disease to Optimize Management of AML, ALL, and Chronic Myeloid Leukemia.Am Soc Clin Oncol Educ Book . 2023 Jun;43:e390010. doi: 10.1200/EDBK_390010.


