Science:中国科学家团队研发出新型快速抗抑郁化合物
时间:2022-01-28 16:19:01 热度:37.1℃ 作者:网络
据世界卫生组织统计,全球约有超过3亿抑郁症患者,其中约2/3的患者有过自杀意念,约1/4的患者有过自杀行为。自杀同时也是当下年轻人死亡的主要原因之一,并有将近一半发生在抑郁症患者中。目前市售的传统抗抑郁药物通常需要长达几周甚至几个月后才能起效,并且对三分之一的难治性抑郁症患者没有改善作用。
近年来,多种致幻剂在抑郁症治疗方面展现了一定的潜能1。从“神奇蘑菇”中提取的一种天然致幻剂裸盖菇素(Psilocybin),于2019年被美国FDA授予治疗重度抑郁症和药物抵抗性抑郁症的突破性疗法1-3。二期临床研究结果表明,裸盖菇素单次用药一天内即可极大改善抑郁症患者的症状,且效果可持续三个月以上4。但是,致幻剂的致幻副作用极大地限制了它们的临床研究和广泛应用。因此全世界的科学家一直致力于寻找和研发非致幻且能快速起效的新型抗抑郁药。

2022年1月28日,来自中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)汪胜研究组与上海科技大学iHuman研究所程建军研究组合作在Science杂志发表了题为Structure-based discovery of non-hallucinogenic psychedelic analogs 的研究论文。该项工作从解析致幻剂与其靶点血清素2A受体(5-HT2AR)的复合物结构出发,发现致幻剂除了先前预测的与5-HT2AR的经典结合模式之外,存在另一种位于经典结合模式上方的、受脂质调控的结合模式。研究人员发现在脂质分子存在下,致幻剂的第二种结合模式对于5-HT2AR下游β-arrestin信号的偏好性激活至关重要;进一步实验结果表明致幻剂的致幻效果与G蛋白和β-arrestin两条下游信号同时高效率激活密切相关。基于第二种结合模式,研究人员设计并合成了以IHCH-7086和IHCH-7079为代表的一系列5-HT2AR的β-arrestin信号偏好性激动剂;并在动物体内实验中证明该系列化合物无致幻作用,但具备与致幻剂相似的快速抗抑郁效果。
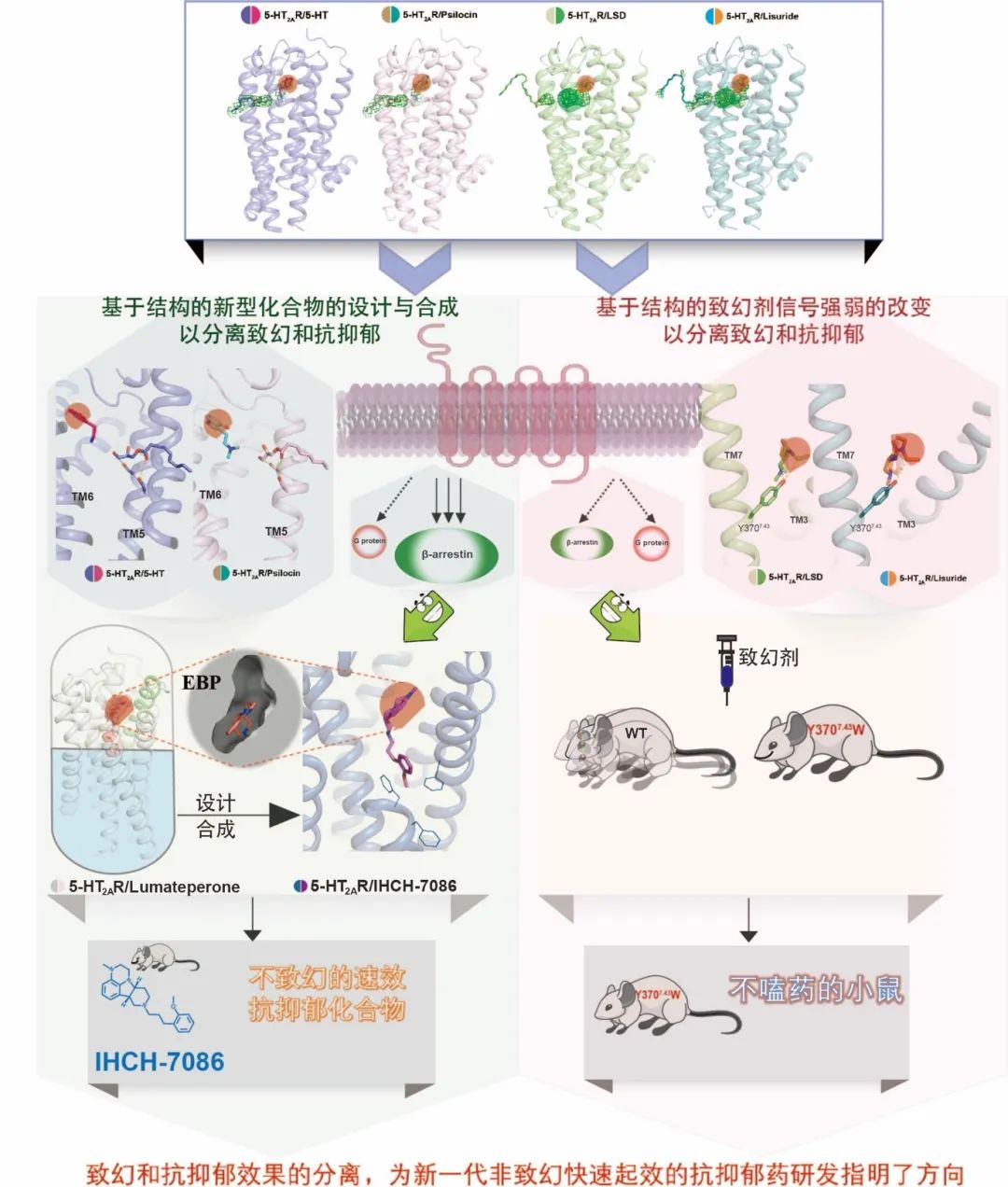
1
脂质对血清素2A受体的激活
Psilocybin(裸盖菇素)在人体内被代谢为psilocin(脱磷酸裸盖菇素),后者与5-HT2AR结合发挥作用。汪胜研究组首先解析了5-HT2AR与内源性配体serotonin(血清素),致幻剂psilocin,致幻剂LSD(麦角酸二乙基酰胺)以及非致幻剂lisuride(麦角乙脲,帕金森病药物)等四种复合物的晶体结构。LSD和lisuride的麦角灵骨架的结合位置与实验室前期解析的其他麦角灵药物类似,均结合在正位结合位点(orthosteric binding pocket,OBP)5,6;与之前预测的正位结合位点不同,serotonin和psilocin受脂质调控结合在OBP上方的延伸性口袋(Extended binding pocket,EBP)。进一步实验结果表明该脂质为monoolein(甘油单油酸酯),可占据5-HT2AR独有的侧边口袋(side-extended pocket,SEP),并与TM5的残基有一定的极性相互作用。实验表明monoolein通过G2385.42残基位置进入OBP,激活5-HT2AR下游的G蛋白信号并且该信号的激活可以被5-HT2AR的选择性抑制剂MDL100907所抑制。
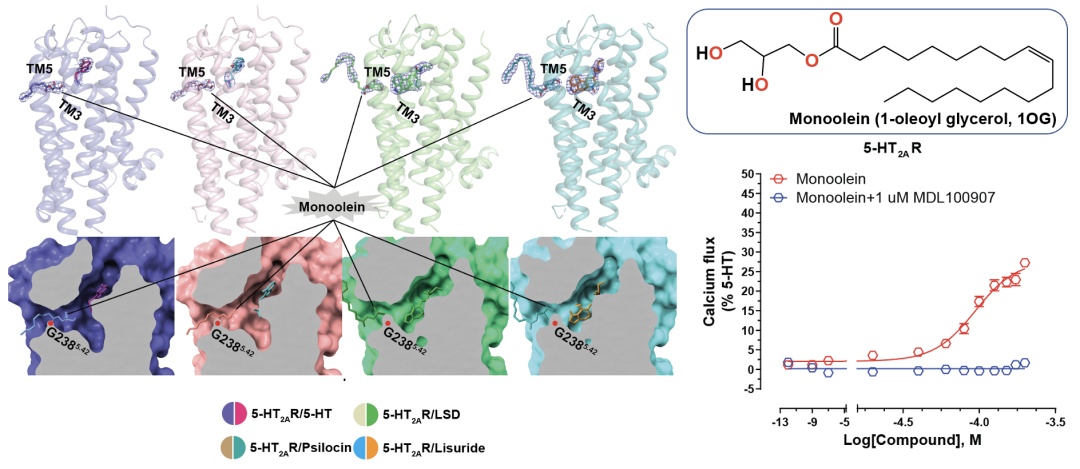
图1 脂质对5-HT2AR的激活
2
serotonin和psilocin在血清素2A受体中的第二种结合模式
研究人员认为serotonin和psilocin在5-HT2AR中的两种不同的结合形式(OBP和EBP),可能对受体功能产生不同的影响。实验发现单独monoolein无法激活5-HT2AR下游的β-arrestin信号,但在serotonin存在的情况下可剂量依赖性地激活β-arrestin信号。相比之下,LSD存在的情况下,未能深入OBP的monoolein则不能激活β-arrestin信号。结果表明serotonin和psilocin的第二种结合模式对其β-arrestin信号的激活至关重要。
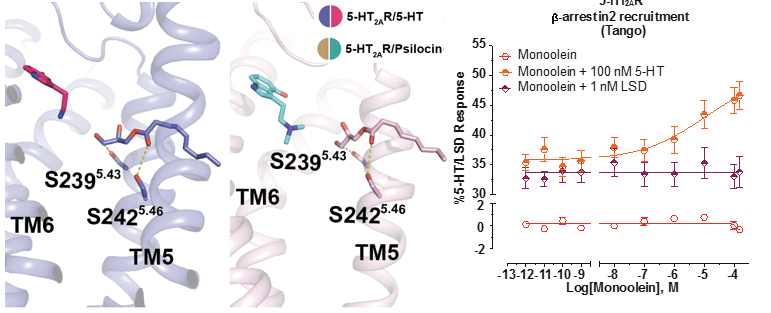
图2 脂质存在下serotonin和psilocin结合在EBP中
对5-HT2AR-LSD和5-HT2AR-lisuride结构的比对表明,LSD中的两个乙基均接触EBP中的残基Y3707.43,而lisuride只有一个乙基与其相互作用。实验发现5-HT2AR -Y3707.43W突变体能显著提高lisuride的β-arrestin信号,而对于G蛋白信号影响不大。然而由于Y3707.43直接与LSD的两个乙基相互作用,Y3707.43W突变体同时降低了LSD介导的G蛋白信号和β-arrestin信号。结果表明虽然LSD和lisuride在OBP中结合模式相似,但在EBP中结合模式的不同导致其与TM7的相互作用不同,从而影响了下游的β-arrestin信号。
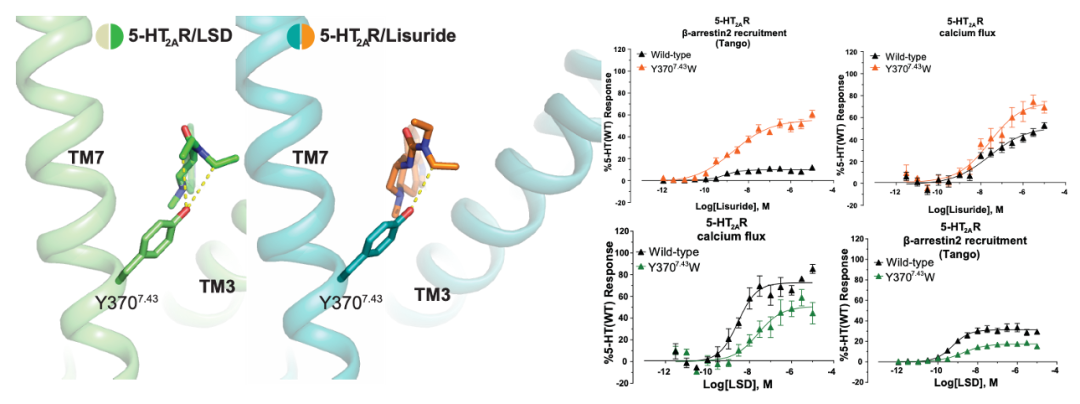
图3 Y3707.43对lisuride和LSD激活5-HT2AR下游信号的影响
早期多种研究表明致幻剂对5-HT2AR的亲和力与其精神活性密切相关7,8。动物行为模型不能精确地捕捉到由致幻剂在人类中产生的知觉、认知和情绪的扰动。然而,研究表明,小鼠头部抽搐反应(Head twitch response,简称HTR)与人类产生致幻剂诱导产生的幻觉密切相关9。研究人员进一步通过搭建的基于磁信号检测小鼠HTR的模型中验证了5-HT2AR-Y3707.43W点突变小鼠可以成功抹去LSD的HTR效应,同时保留了LSD的抗抑郁效果。结果表明致幻剂的精神活性作用需要5-HT2AR介导高效率的信号转导,且致幻剂的致幻效果和抗抑郁效果可通过改变5-HT2AR激动剂的药理学活性而分离。
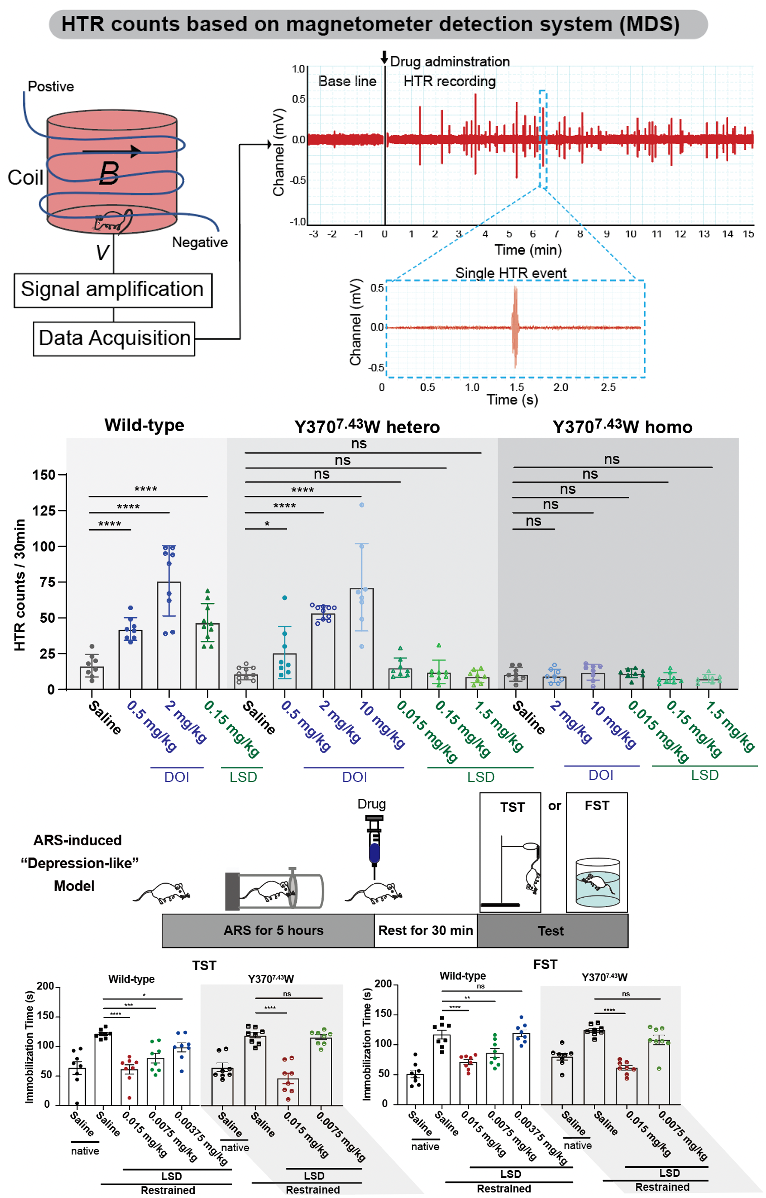
图4 5-HT2AR-Y3707.43W小鼠对LSD的致幻和抗抑郁效果的影响
3
以结构为导向合成β-arrestin信号偏好性化合物
通过上述数据,研究人员推测靶向EBP可以增强5-HT2AR介导的β-arrestin信号,有利于设计出β-arrestin信号偏好性配体。实验室前期的研究结果表明抗精神病药物的头部基团均与其GPCR靶向受体的EBP相结合10,11,并且5-HT2AR是非典型抗精神病药物的重要靶点之一。通过分析市售的几十种抗精神病药物,研究人员锁定了2019年FDA批准上市的lumateperone(卢美哌隆,5-HT2AR的抑制剂)12;并解析了其与5-HT2AR的复合物晶体结构,发现lumateperone头部基团的四环骨架结合在5-HT2AR的EBP。研究人员基于结构设计并合成了头部基团:IHCH-7113。进一步数据表明,IHCH-7113具有微弱的β-arrestin信号偏好性且在5-HT2AR两条下游信号通路中均具有较高的激活效率,可诱导小鼠产生HTR。
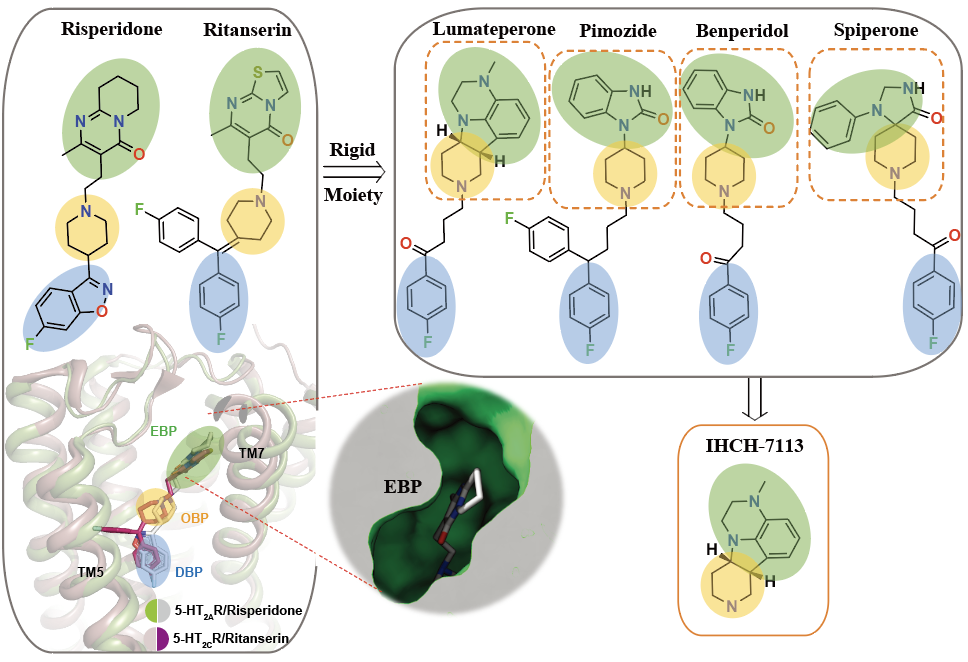
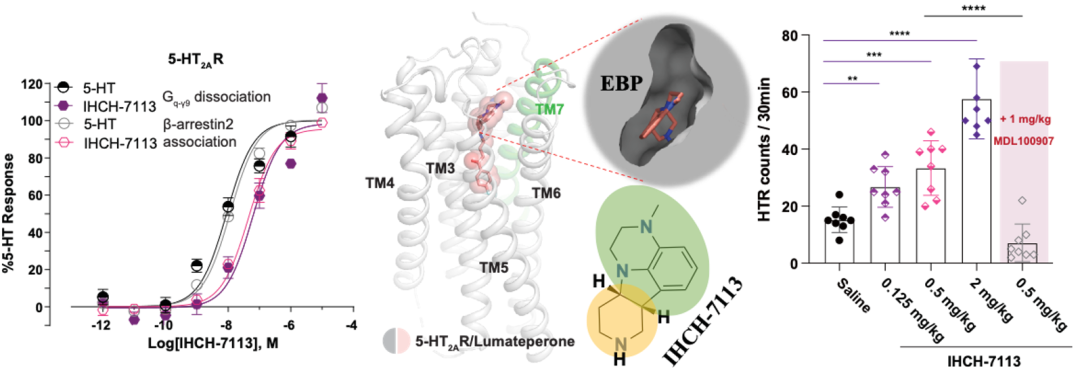
图5 IHCH-7113的结构设计思路、激活信号和致幻效果
进一步通过以结构为导向的化合物理性设计,研究人员在IHCH-7113的基础上引入甲氧基苯基合成了IHCH-7086及其系列衍生物;使其相对lumateperone的氟苯基避开5-HT2AR的PIF结构域(决定了lumateperone的抑制剂效果);同时按照设计,该系列化合物将以结合EBP为主(β-arrestin偏好),同时避开结合OBP的脂质结合口袋(G 蛋白偏好)。通过解析IHCH-7086和5-HT2AR的复合物晶体结构,IHCH-7086在5-HT2AR中的结合模式的确如研究人员所设想,且IHCH-7086表现出明显的β-arrestin信号偏好性。
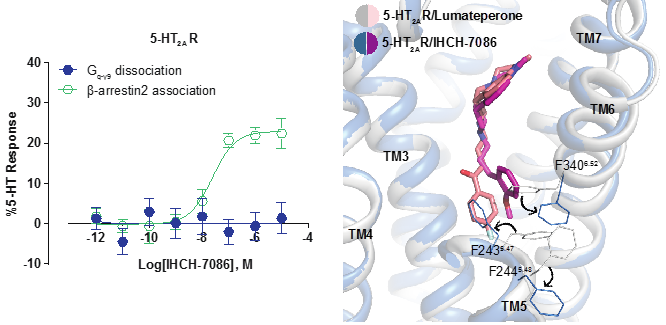
图 6 IHCH-7086的激活信号和与5-HT2AR结合的复合物结构
4
5-HT2AR介导的下游信号在致幻和抗抑郁行为中的效果
研究人员进一步通过基于磁信号检测小鼠HTR的模型中检测了IHCH-7086,IHCH-7079(IHCH-7086类似物)的致幻效果,结果表明具有明显的β-arrestin信号偏好性的IHCH-7086和IHCH-7079在注射高剂量(10 mg/kg)的情况下也不会诱导小鼠产生HTR。
随后研究人员在不同方法构建的小鼠抑郁样模型中验证了IHCH-7086和IHCH-7079的抗抑郁效果,实验结果表明IHCH-7079和IHCH-7086与先前已报道的LSD所具有的抗抑郁效果类似,能够明显改善小鼠的抑郁样行为,并且5-HT2AR的选择性抑制剂MDL100907能抑制它们的改善作用。
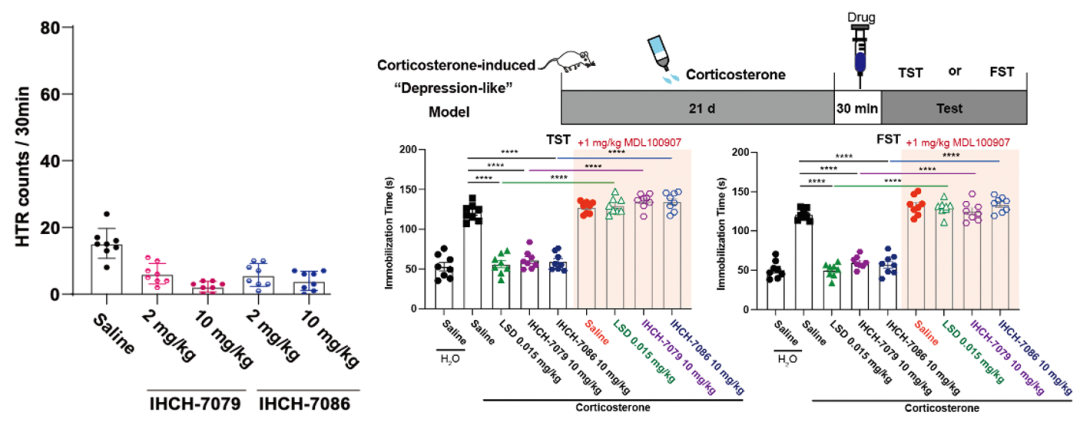
图7 IHCH-7086和IHCH-7079的致幻和抗抑郁效果
该项工作对于psilocybin这一类致幻剂的研究,不仅深入阐明致幻的分子机制,同时有助于理解致幻剂缓解抑郁症的药理机制,为新型速效、长效抗抑郁药物的研发提供理论指导。需要指出的是,化合物并不等同于药品,该研究团队的科研人员正在进行系统的化合物成药性验证以及先导化合物的持续优化工作,争取早日使其成为造福患者的药品。致幻剂的“改邪归正”之路依旧“路漫漫其修远兮”,研究人员将会继续“吾将上下而求索”。
分子细胞卓越中心汪胜研究组博士研究生曹冬梅、助理研究员余竞、上海科技大学程建军组助理研究员王欢、苏州大学罗智璞教授和分子细胞卓越中心李劲松研究组博士研究生刘芯宇为该论文的共同第一作者,分子细胞卓越中心汪胜研究员和上海科技大学iHuman研究所程建军研究员为该论文的共同通讯作者。同时该项工作也得到了分子细胞卓越中心李劲松院士和公安部第三研究所林何博士的协助。该项研究工作得到了科技部重点研发项目、中国科学院战略先导项目、国家自然科学基金、科技部青年千人基金、上海市科学技术委员会启明星计划项目等资助。该项研究工作同时得到了分子细胞卓越中心化学生物学技术平台和动物实验技术平台的大力支持。
参考文献:
1 Nutt, D., Erritzoe, D. & Carhart-Harris, R. Psychedelic Psychiatry's Brave New World. Cell 181, 24-28, doi:10.1016/j.cell.2020.03.020 (2020).
2 Carhart-Harris, R. L. The entropic brain - revisited. Neuropharmacology 142, 167-178, doi:10.1016/j.neuropharm.2018.03.010 (2018).
3 Ross, S. et al. Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol 30, 1165-1180, doi:10.1177/0269881116675512 (2016).
4 Carhart-Harris, R. et al. Trial of Psilocybin versus Escitalopram for Depression. N Engl J Med 384, 1402-1411, doi:10.1056/NEJMoa2032994 (2021).
5 Wacker, D. et al. Crystal Structure of an LSD-Bound Human Serotonin Receptor. Cell 168, 377-389 e312 (2017).
6 McCorvy, J. D. et al. Structural determinants of 5-HT2B receptor activation and biased agonism. Nat Struct Mol Biol 25, 787-796, doi:10.1038/s41594-018-0116-7 (2018).
7 Glennon, R. A., Titeler, M. & McKenney, J. D. Evidence for 5-HT2 involvement in the mechanism of action of hallucinogenic agents. Life Sci 35, 2505-2511, doi:10.1016/0024-3205(84)90436-3 (1984).
8 Sadzot, B. et al. Hallucinogenic drug interactions at human brain 5-HT2 receptors: implications for treating LSD-induced hallucinogenesis. Psychopharmacology (Berl) 98, 495-499, doi:10.1007/BF00441948 (1989).
9 Nichols, D. E. Psychedelics. Pharmacol Rev 68, 264-355, doi:10.1124/pr.115.011478 (2016).
10 Wang, S. et al. Structure of the D2 dopamine receptor bound to the atypical antipsychotic drug risperidone. Nature 555, 269-273 (2018).
11 Fan, L. et al. Haloperidol bound D2 dopamine receptor structure inspired the discovery of subtype selective ligands. Nat Commun 11, 1074, doi:10.1038/s41467-020-14884-y (2020).
12 Vanover, K. E. et al. Dopamine D2 receptor occupancy of lumateperone (ITI-007): a Positron Emission Tomography Study in patients with schizophrenia. Neuropsychopharmacology 44, 598-605, doi:10.1038/s41386-018-0251-1 (2019).


