她的成长被按了“倒退键”,正值妙龄,却走路跌倒,不能说话
时间:2024-10-14 06:03:37 热度:37.1℃ 作者:网络
去年10月,一对父母推着轮椅来到神经内科问诊,坐在轮椅上的是一个15岁的小姑娘,她一直在傻笑着。医生仔细的询问了孩子的病史:原来这个女孩名叫(燕子),从小成绩优异,使人们口中“别人家的孩子”,但是,在她9岁那年,她的生活发生了改变:注意力不集中、走路容易跌跤、智力逐渐退化,还时伴有肢体抽搐、间断痴笑、语言能力渐渐丧失,燕子的成长就像被按了“倒退键”。
真相大白
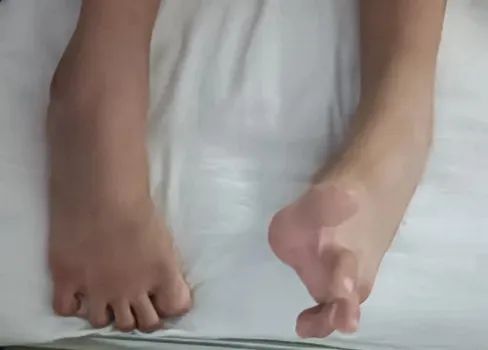
经过检查,医生发现燕子除了智力退化及语言功能丧失外,还存在高弓足,马蹄内翻足畸形(图1),双下肢肌张力高,四肢腱反射亢进等。燕子的父母说,她11岁的弟弟智力也不及同龄孩子,难道是遗传病?经过基因检测,燕子和她的弟弟存在NPC1基因突变。燕子成长倒退的原因找到了,她被诊断为尼曼匹克病(C型)。
尼曼匹克病(Niemann-Pick disease,NPD),也被称为鞘磷脂胆固醇脂沉积症,是一组罕见的脂质代谢异常的溶酶体贮积症。过量脂类累积于病人的肝脏、肾脏、脾脏、骨髓等,甚至脑部,而造成这些器官的病变。国外不同人种之间 NPD-A/B 型发病率为 1/250000~1/44960,NPD-C型发病率为1/150000~1/100000,国内缺乏准确的发病率调查。
致病基因
过量脂类累积于病人的肝脏、肾脏、脾脏、骨髓甚至脑部等,造成这些器官出现相应轻重不同的症状。NPD主要包括A/B型(NPD-A/B)和C型(NPD-C)。NPD-A(MIM257200)/B型即酸性鞘磷脂酶缺乏症(acidsphingomyelinase Disease,ASMD),是由于SMPD1基因突变所致;NPD-C是因NPC1或NPC2基因突变导致胆固醇转运障碍所致。
临床表现
尼曼匹克病临床上主要可分为 A、B和C型。A、B型是由于酸性神经鞘磷脂酶缺乏或活性不足,C型是由于细胞内胆固醇代谢、运输障碍。严重的神经系统影响主要发生在A、C型,B型则无神经系统的问题。
A型属于最严重型,生命期通常小于三年。患者酸性神经鞘磷脂酶几乎没有活性,导致神经鞘磷脂累积在肝、脾、肺等器官与神经系统。新生儿可出现肝脾肿、发育迟缓,最终痉挛和强直。约半数患者有眼底异常,还可有肺部病变导致呼吸衰竭。
B型患者相较于A型患者,其酸性神经鞘磷脂酶还有活性,临床症状较轻微,神经系统可能只有轻微受损或完全正常,生命期也较久。主要症状有腹部膨隆、肝脾肿大。
C型患者与A、B型不一样,是由于NPC蛋白功能异常导致细胞内胆固醇的累积。常学龄期发病,也有部分成年后发病。NPD-C的常见临床表现包括认知障碍、共济失调、垂直注视麻痹、肌张力障碍、肝脾肿大、吞咽困难、肺功能受损等[1]。婴幼儿期最早的症状之一是肝脾肿大;儿童期和青少年期多表现为言语和运动能力落后;青少年期及成人期神经系统症状进一步加重,如认知障碍、共济失调、肌张力异常。
检查与诊断
常规检查
①血常规:脾功能亢进患者可出现血小板减少,甚至出现全血细胞减少。
②肝功能:大部分患者肝脏转氨酶轻度至中度升高。
③血脂:甘油三酯轻中度升高、高密度脂蛋白胆固醇降低、低密度脂蛋白胆固醇升高。
④酸性鞘磷脂酶活性检测:外周血淋巴细胞或皮肤成纤维细胞培养酸性鞘磷脂酶活性低于正常下限的30%可以确诊NPD-A/B型。
影像学检查
①肺部:肺高分辨率CT可以发现小叶间隔增厚、磨玻璃密度影和钙化等。
②头颅:NPD-A型患者头颅MRI可以正常,也可以表现为脑萎缩,部分患者可以出现白质T2高信号。
组织病理检查
活组织检查发现泡沫细胞提示尼曼匹克病可能,但阴性并不能除外此病。
基因分析
检出2个等位基因已知致病变异可以确诊NPD-A/B型。
诊断
NPD-A/B型:结合临床症状,确诊有赖于外周血淋巴细胞或皮肤成纤维细胞培养酸性鞘磷脂酶活性降低或 SMPD1基因分析检出2个等位基因致病变异。
NPD-C型:对于临床疑似患者,尤其骨髓涂片见尼曼匹克细胞而酸性鞘磷脂酶活性正常的患者,建议行NPC1和NPC2基因突变分析,以明确诊断。
治疗
目前,NPD仍缺乏有效的治疗手段,整体上预后仍差,但可以通过多学科的综合治疗减轻患者症状,延长生存期。A型缺乏有效治疗办法,以姑息治疗为主,主要治疗目标控制症状,控制感染,提高生命舒适度。B型患者建议尽早进行骨髓移植,出现严重系统损害后移植效果差。C型患者可以有更多的治疗方法。
主要的治疗方法有:
1、对症治疗 对于NPD-A/B型患者应积极控制肺部感染,缓解呼吸困难;脾功能亢进贫血的患者需补充红细胞。对于NPD-C型患者针对睡眠障碍和惊厥,可以考虑镇静和抗惊厥治疗;针对运动功能减退,给予物理治疗;吞咽困难导致进食困难并因此常引起吸入性肺部感染,可以尝试通过胃肠造瘘术给予胃肠营养。
2、酶替代治疗(ERT) 重组人酸性鞘磷脂酶(recombinant human ASM,rhASM)目前已在NPD-A/B成人患者种进行Ⅱ期临床试验(NCT02004 691)。
3、底物减少疗法 美格鲁特(miglusta)通过抑制鞘糖脂合成进而阻止或延缓NPD-C型患者神经系统症状的进展,可用于4岁以上NPC1突变有神经系统受累表现的NPD-C型患者。
4、骨髓移植 对于NPD-A/B型患者可以在一定程度上缩小肝脾体积,延缓疾病进展,但对神经系统症状改善不明显。
虽然目前针对NPD-C病因缺乏有效的治疗方法,但葡萄糖神经酰胺合成酶抑制剂麦格司他,是中国唯一获批准治疗NPD-C的药物且2020年被纳入国家医保,可稳定、改善患者进行性加重的神经症状,延缓病情的进展,被国内外多个权威指南推荐。
可喜的是,在2024年FDA已批准了批准Zevra 的Miplyffa口服适用和麦格司他联合治疗2岁及以上的儿童和成人尼曼匹克病C型(NPC)。接着,FDA批准第二款治疗尼曼匹克病C型(NPC)药物-Aqneursa上市。
预后
NPD-A:快速进展,患者多在3岁前死亡。
NPD-B:预后好于NPD-A,患儿可能活到童年后期或成年早期。但可能会因疾病而出现并发症
NPD-C:不同患者的预期寿命不同
如果在婴儿期患病,5 岁以后存活的可能性较小
如果5岁后患病,可能活到成年
参考资料:
1. 连娣,吴静,李玲.尼曼匹克病C1型合并抗GQ1b抗体阳性1例[J].中华实用儿科临床杂志,2024,39(9):691-694.
2. 章瑞南,邱文娟,叶军,等. 尼曼-匹克病C型一家系基因突变分析及产前基因诊断[J]. 中华围产医学杂志,2013,16(12):750-754.
3. [1]唐湘凤.尼曼-匹克病诊治进展[J].传染病信息, 2019, 32(2):4.DOI:10.3969/j.issn.1007-8134.2019.02.015.
4. [2]刁倩,黄延风.尼曼匹克病的研究进展[J].儿科药学杂志, 2022(007):028.
5. [3]潘静,耿哲,江华,等.异基因造[8] 血干细胞移植治疗儿童尼曼匹克病1例报告[J].中国当代儿科杂志,2013,15( 9) : 782-784.
6. 罕见病诊疗指南(2019).517-513.


